氨基酸长期以来被广泛用于药物制剂中,作为赋形剂防止蛋白聚集、延长药效。例如,在免疫球蛋白药物(如 Cuvitru®、Privigen®、Hizentra®)中,脯氨酸与甘氨酸已被反复验证具有良好的稳定作用。然而,这一效应的机制始终不明:这些小分子究竟如何起效?它们的作用是否仅限于蛋白质,还是更广泛的胶体物理现象?
2025年9月10日,洛桑联邦理工学院(EPFL)Francesco Stellacci教授、麻省理工学院(MIT)Alfredo Alexander-Katz教授、南方科技大学(SUSTech)罗智教授组成的联合团队在Nature 上以 “Stabilizing effect of amino acids on protein and colloidal dispersions”为题发表研究论文,首次提出并验证了一种普适的胶体稳定机制。该机制不仅解释了氨基酸的稳定效应,还建立了一个可定量预测的新理论模型,为药物配方、蛋白稳定剂、纳米材料等多个领域提供了理论基础与设计工具。

图1:小分子提升胶体稳定性的理论框架。
小分子如何稳定大分子?关键在“第二维里系数”
研究人员通过测量第二渗透压维里系数(B22)和平均力势(PMF),系统评估了氨基酸对蛋白质、DNA 和无机纳米颗粒等不同类型胶体的影响。结果显示,加入氨基酸可显著提高 B22,增强颗粒之间的排斥作用,从而抑制聚集。这一效应与盐的作用方向相反——盐通过“屏蔽排斥力”降低 B22,使颗粒更易聚集,而氨基酸则通过“吸引屏蔽”机制削弱胶体间的吸引力,提升稳定性。
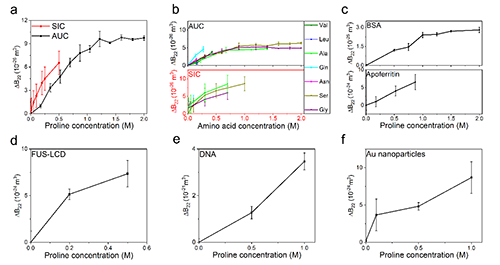
图2:不同蛋白质、DNA和纳米体系在加入氨基酸后,二体渗透系数(B22)普遍增加。
就像在一条拥挤的走廊里,两位本想打招呼的同事被人群隔开、错身而过,氨基酸在溶液中增加了“背景小分子密度”,从而让胶体彼此“看不见”对方,降低聚集概率。
提出可预测的新理论:胶体表面“斑块模型
为理解这一现象,研究团队提出了一个新模型:将胶体颗粒视为表面带有“斑块”的粒子,氨基酸以Langmuir 等温吸附的方式可逆地结合在这些位点上,部分遮蔽颗粒间的结合能力。随着氨基酸浓度升高,未被“遮挡”的吸引斑块减少,B22 值随之上升,反映出体系更加稳定。
这一模型不仅可拟合脯氨酸、甘氨酸、丝氨酸、丙氨酸等的实验数据,其参数还与动态光散射等测量方法所获得的蛋白尺寸相吻合。同时,该理论也成功解释了文献中关于乙醇、蔗糖、甘油等非生物小分子对蛋白稳定作用的数据。
研究由此提出三个重要结论:
1.带电氨基酸只会稳定带有相反电荷的蛋白质;
2.短肽的稳定效果与等量单体氨基酸相当,甚至更强;
3.所有能与胶体发生弱相互作用的小分子,只要能增强表面溶剂化,都可能成为有效的稳定剂。
换言之,这一理论揭示了一个普适的、非特异性的胶体物理机制,并提供了可预测的数学模型,填补了长期以来生物制剂设计中的理论空白。
从胰岛素案例到细胞稳态的新思路
作为该理论的直接应用,研究团队尝试将脯氨酸用于优化胰岛素制剂。在超离心实验中发现,脯氨酸能减少胰岛素六聚体的形成,增加其单体和二聚体比例。进一步的动物实验显示,添加 1 M 脯氨酸后,胰岛素在小鼠体内的血浆浓度–时间曲线下面积几乎翻倍,峰值浓度也提高了一倍,显著提升了其体内生物利用度。研究人员指出,这一发现不仅为胰岛素等药物的配方优化提供了新思路,也凸显了氨基酸等小分子作为“隐形作用力”在药物稳定性提升中的潜力。

图3. 脯氨酸能抑制蛋白质相分离;减少了应激颗粒(stress granules)的形成;提升了胰岛素的生物利用度。
此外,这项工作还为理解细胞内分子稳态提供了新视角。例如,在渗透压胁迫下,细胞会积累脯氨酸;在蛋白降解过程中,也会释放氨基酸与短肽。这些分子虽常被视为“代谢背景”,实则可能通过调节 B22 持续影响细胞内蛋白–蛋白相互作用、相分离行为,乃至更广泛的结构功能调控。
展望:推动药物与材料体系的理性配方设计
尽管盐浓度在多数生物化学实验中被严格控制与系统报告,氨基酸及其他小分子溶质的浓度对胶体体系行为的影响却长期被忽视。本研究强调,这些小分子虽不直接参与反应,却可通过弱相互作用显著调控蛋白聚集与溶液稳定性,其浓度应与pH、离子强度等参数一道,纳入制剂开发与实验设计的标准化记录体系。目前,研究团队正致力于将该理论进一步拓展为面向药物、食品与生物材料领域的智能配方设计工具,以期在复杂体系中实现对稳定性与功能性的定量预测与精准调控。
论文链接:https://www.nature.com/articles/s41586-025-09506-w
