抗肿瘤材料通常被设计为直接杀伤肿瘤细胞。然而,现有研究大多将其视为仅能发挥一次性作用的工具,其疗效高度依赖于局部累积剂量。如何使材料的作用不再局限于单次杀伤,而是在肿瘤微环境中实现持续、级联扩增式的效应,仍是当前面临的挑战。
近日,中国科学院长春应用化学研究所陈学思、丁建勋团队报道了一种阳离子聚氨基酸材料EG45-D-K-D-pYA。该材料可在肿瘤细胞/组织内部发生原位自组装,诱导微泡生成,并触发一种可持续扩展的级联旁观者杀伤效应(图1)。
2026年1月6日,相关工作以“A Tumor-Selective Self-Assembling Network of Poly(amino acid) Induces Cascading Bystander Cytotoxicity through Microvesicle Fission Amplification”为题发表在《Journal of the American Chemical Society》上。
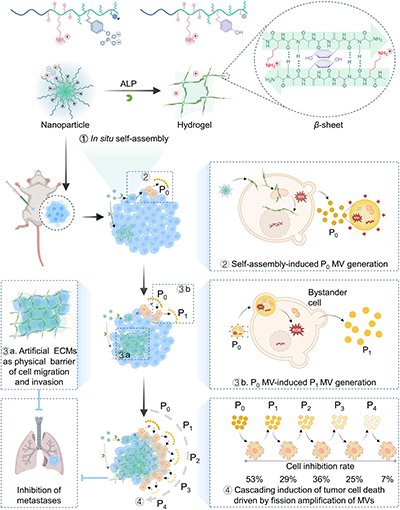
图1.肿瘤响应性阳离子聚氨基酸EG45-D-K-D-pYA在体内自组装形成阳离子网络,诱导肿瘤细胞释放微泡,并通过微泡的多代传递实现级联旁观者杀伤效应,同时自组装形成的类细胞外基质结构能够有效抑制肿瘤转移。
在肿瘤高表达的碱性磷酸酶(ALP)催化下,EG45-D-K-D-pYA的磷酸酯键断裂,引发二级结构转变——β-折叠含量从40.6%显著提升至83.3%,同时材料表面电荷发生反转,ζ电位由-4.95 mV转变为+25.0 mV。这一协同变化驱动体系从分散的纳米颗粒状态转变为连续的三维阳离子网络结构(图2)。该网络首先富集于肿瘤细胞膜,继而作用于线粒体与细胞核等关键细胞器,导致细胞内活性氧(ROS)水平急剧上升,破坏细胞稳态并最终诱导肿瘤细胞死亡。在此过程中,受损肿瘤细胞释放出大量微泡(图3)。这些微泡富含阳离子聚氨基酸材料以及细胞膜、线粒体和细胞核相关成分,具有较高的正电性(ζ电位约+32.9 mV)与显著生物活性。进一步研究显示,微泡可被邻近肿瘤细胞选择性摄取,并在受体细胞中诱导新一代微泡生成(图4),从而在肿瘤细胞群体中形成跨越多代的级联传递杀伤效应。在代际传递过程中,微泡表面正电性逐渐下降,其携带的ROS水平于第二代(P2)达到峰值后开始衰减,对应的旁观者杀伤效应在P0至P4代中分别表现为约53%、29%、36%、25%和7%的细胞抑制率,揭示了一种受ROS与表面电荷协同调控的非线性级联衰减过程。与此同时,在组织层面,自组装形成的三维阳离子网络可模拟类细胞外基质结构,作为物理屏障抑制肿瘤细胞的迁移与转移,从而协同实现持续的肿瘤生长抑制与转移控制。

图2. 在37 °C条件下,EG45-D-K-D-pYA(10.0 mg mL-1)经ALP(10.0 U·mL-1)催化反应不同时间(0、3、6和24 h)后的冷冻扫描电子显微镜(cryo-SEM)图像。

图3. 4T1细胞经EG45-D-K-D-pYA处理后,分别于3、6、12及24 h拍摄的扫描电子显微镜(SEM)图像显示了微泡(MV)随时间的形成过程。
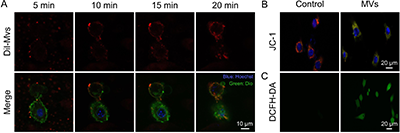
图4. 微泡形成过程的动态检测及组分分析。(A)DiI标记的微泡(红色)与DiO标记的4T1细胞(绿色)共孵育后,在5、10、15和20 min时间点拍摄的时间序列共聚焦激光扫描显微镜(CLSM)图像,展示了二者间的动态相互作用过程。细胞核经Hoechst染色(蓝色)。(B,C)经微泡处理的4T1细胞CLSM成像显示:JC-1染色中,红色荧光代表线粒体膜电位较高的JC-1聚集体,绿色荧光代表膜电位降低的JC-1单体,表明线粒体膜电位发生改变;DCFH-DA染色显示细胞内ROS水平升高。
该研究获得国家自然科学基金、吉林省科技发展计划项目及中国科学院青年创新促进会的支持。
此项工作是该团队在聚氨基酸活体自组装体系研究基础上的进一步拓展。此前,团队围绕酶响应聚氨基酸的精确合成与结构演化,构建了可在生理条件下发生自组装转变的聚氨基酸模型,为理解分子结构、二级构象与组装形态之间的关联奠定了基础(Nano Today 2024, 56, 102222)。在本研究中,团队通过对聚氨基酸结构进行功能化设计,引入阳离子氨基酸单元,意外发现材料在肿瘤细胞内自组装过程中可诱导大量微泡原位生成,并对这一现象进行了系统探索与巧妙利用。这一发现生动展现了材料与生物系统相互作用的复杂性——在真实的生命环境中,材料行为常超出预期,而正是这些“意外”为科学研究带来持续的惊喜与新的应用可能。
原文链接:https://pubs.acs.org/doi/10.1021/jacs.5c09790
- 北大高卫平教授团队《Adv. Mater.》:可用于肿瘤选择性的饥饿氧化及免疫治疗的新型抗癌药物-温敏酸敏型蛋白质-高分子偶联物 2023-02-16
- 清华大学化学系许华平教授课题组招聘博士后 2026-01-14
- 苏大陈倩教授团队《Mater. Today》:超声触发原位自组装药物水凝胶 - 为肝动脉灌注化疗带来新范式 2025-12-20
- 北航陈爱华教授课题组《Macromolecules》:分离原位交联用于提高聚合诱导自组装制备的反相双连续结构的稳定性 2025-10-08
- 北京化工大学王兴/李国锋团队《ACS AMI》:通过聚氨基酸纳米粒子现场递送抗生素消灭细胞内持留性金黄色葡萄球菌 2025-08-16
- 宁波大学陈重一教授 ACS Macro Lett.:基于螺旋结构聚氨基酸的强力生物粘合剂 2025-03-07
- 北化徐福建/赵娜娜/申鹤云《ACS Nano》:两亲性聚氨基酸纳米佐剂介导的光热增强免疫治疗 2024-11-13
