骨整合对于种植牙等永久性植入物发挥着至关重要的作用。这一过程主要取决于成骨细胞在植入物表面的初始黏附,这些细胞分泌的细胞外基质(ECM)对新骨的重塑和矿化至关重要。然而在植入过程中,异物反应引发的伤口愈合反应或由于患者个体差异导致局部组织愈合微环境遭到破坏时,成纤维细胞可能会被募集到植入物附近区域。这会导致纤维包膜的形成,抑制成骨细胞在植入物表面的定植,从而增加骨整合失败的可能性。此外,骨整合受损和纤维包膜的形成会导致植入物松动,并增加植入物-组织界面处细菌生物膜相关感染的风险,最终致使植入物失效。目前,促进成骨细胞黏附和骨整合的策略主要有两种:改变植入物表面形貌,以及用细胞外基质衍生的细胞黏附肽KRSR、RGD等生物活性分子修饰表面。然而,这些策略无法实现理想的成骨细胞选择性黏附和最佳的骨整合效果。大多数现有策略虽能促进成骨细胞黏附,但缺乏对成骨细胞和成纤维细胞的选择性。虽然 KRSR 肽可促进成骨细胞的选择性黏附,但其存在天然肽的常见缺点,如易被蛋白酶水解、大规模合成困难且成本高昂。因此,开发能够选择性促进成骨细胞黏附而非成纤维细胞黏附的生物材料和植入物涂层,对于改善骨整合至关重要。
近日,华东理工大学刘润辉教授课题组设计和发现了一种新的聚合物策略,实现了成骨细胞和成纤维细胞的显著选择性和优异的促骨整合功能。成骨细胞和成纤维细胞因其细胞类型和功能不同,表现出不同的黏附行为,这意味着通过调整表面化学成分和蛋白质吸附来开发成骨细胞选择性生物活性分子具有可行性。β-氨基酸聚合物有望应用于生物材料领域,因为其主链本质上模拟蛋白质,并且克服了细胞外基质衍生肽的缺点,具有出色的抗蛋白酶水解稳定性、易于大规模合成且成本低廉。该研究使用一系列具有不同组成、可调节正电荷和两亲性的两亲性β-氨基酸聚合物(图1),探究成骨细胞与成纤维细胞之间的选择性。值得注意的是,他们观察到这些聚合物对蛋白质的吸附具有可调节性,并确定了一种最优聚合物MM50CH50,其在体外表现出理想的成骨细胞选择性黏附,在大鼠口腔植入模型中具有强大的体内骨整合能力,优于细胞黏附的金标准 RGD和成骨细胞选择性肽KRSR。成骨细胞选择性β-氨基酸聚合物的这些优势及其结构多样性,使这一设计成为一种有前景且有效的策略,用于开发在骨整合早期阶段增强牙科或骨科手术中植入物骨整合、预防无菌性松动的生物材料。

2025年8月5日,该研究成果以“Promoting implant osseointegration via the osteoblast-selective β-amino acid polymer strategy”为题发表在Nature Communications上(Nat. Commun. 2025, DOI: 10.1038/s41467-025-58394-1)。

图1. 具有成骨细胞选择性的β-氨基酸聚合物高通量筛选
为揭示细胞选择性黏附机制,并深入了解在非选择性条件下成骨细胞和成纤维细胞黏附行为及细胞内事件的差异,对在RGD表面培养的细胞进行RNA测序(RNA-seq)。他们发现一些基因(如 Diaph3、Baiap2、Enah、Wasl、Arpc4、Arpc5、Arpc5l、Cyfip2、Brk1和Tmsb4x)在成骨细胞中的表达水平高于成纤维细胞,且它们均分别参与与丝状伪足和片状伪足形成相关的Cdc42到Arp2/3通路以及Rac到Arp2/3通路(图2)。此外,由于肌球蛋白轻链(MLC)的激活,成骨细胞中肌动球蛋白应力纤维的形成也得到促进(图2)。对于成纤维细胞,一些基因(PtK2、Bcar1、Crk、Src、Vcl、Actn1、Actn4、Pikfyve、Pip5k1c 和 Pip5k1a)的表达水平高于成骨细胞,且它们均位于与黏着斑和F-肌动蛋白形成相关的通路中。
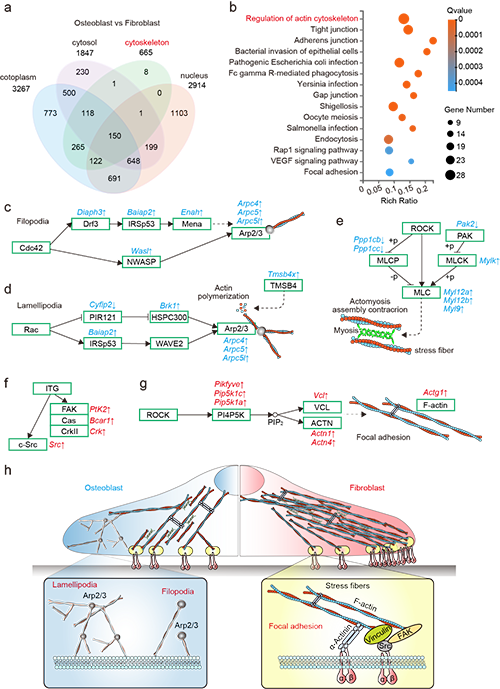
图2. 成纤维细胞和成骨细胞在RGD表面黏附的RNA-seq分析
他们推测成骨细胞形成更多的丝状伪足和片状伪足以促进黏附和铺展,而成纤维细胞可能依赖更多的黏着斑和应力纤维来实现成熟黏附。片状伪足和丝状伪足通常出现在细胞初始黏附或迁移阶段,而黏着斑的形成依赖于整合素的聚集。他们进一步检测了Lamin A/C(一种响应机械信号的核心核纤层成分)和整合素β1(参与细胞黏附和机械转导,其组装表明与RGD的结合增加)的表达。结果表明,与成骨细胞相比,成纤维细胞具有更强的细胞内力,这可能是由于成纤维细胞的应力纤维数量更多,并且它们依赖更多的RGD结合位点来平衡这些纤维束的收缩力。

图3. 优选聚合物表面成骨细胞选择性黏附的机理研究
进一步的,他们通过EDTA阻断实验和调控RGD密度的相关实验发现成纤维细胞和成骨细胞具有不同的黏附机制。成纤维细胞的应力纤维更多,其细胞内力比成骨细胞更强,这导致它们对表面RGD密度的反应不同,即成纤维细胞的黏附和铺展相比成骨细胞需要更高密度的RGD。这一点在MM50CH50表面成纤维细胞中Lamin A/C和整合素β1的表达明显低于RGD表面的观察结果中得到了印证。成骨细胞选择性的MM50CH50表面通过调控吸附的血清蛋白(包括细胞黏附蛋白(如FN)和BSA),使其呈现出比非选择性表面更少的暴露RGD,从而有利于成骨细胞黏附,而不利于成纤维细胞黏附。因此,细胞黏附蛋白和BSA都对MM50CH50的成骨细胞选择性黏附有重要贡献。

图4. 成纤维细胞和成骨细胞在优选聚合物表面黏附的RNA-seq分析
为了进一步探究MM50CH50对成骨细胞选择性黏附的潜在机制,他们采用RNA-seq分析MM50CH50表面上成骨细胞与成纤维细胞在细胞黏附方面的差异。发现与丝状伪足和片状伪足形成相关的基因在成骨细胞中的表达水平高于成纤维细胞。层次聚类分析和火山图结果显示,在MM50CH50表面,成骨细胞中与驱动丝状伪足和片状伪足形成相关的基因(如 Wasl、Diaph3、Enah 和 Baiap2)相较于在 RGD 表面出现上调(图4)。为了评估片状伪足和丝状伪足是否促进成骨细胞黏附,他们使用了针对肌动蛋白成核因子的小分子抑制剂,包括 NSC23766(Rac 抑制剂)、CK666(Arp2/3 抑制剂)和 SMIFH2(Formin 抑制剂)来处理人原代成骨细胞(图5)。与 RNA 测序分析结果一致,抑制片状伪足或丝状伪足的形成会导致细胞在MM50CH50表面的铺展面积减小(图5),这表明在表面吸附的血清蛋白中暴露的RGD相对低密度的情况下,基于伪足的黏附可能是促进成骨细胞黏附和铺展的主要途径。

图5. 使用不同小分子抑制剂观察成骨细胞和成纤维细胞在RGD和优选聚合物表面的黏附形态
为了全面了解成骨细胞选择性的机制,他们继续使用小分子抑制剂探究细胞内力和应力纤维对细胞黏附和铺展的影响。这些抑制剂用于调节人原代成骨细胞和人原代成纤维细胞中基于肌动球蛋白的收缩性,其中包括 Blebbistatin(一种肌球蛋白 II 抑制剂)、Calyculin A(一种促进肌球蛋白收缩的磷酸酶抑制剂)和Y - 27632(一种阻止应力纤维形成的ROCK抑制剂)。结果显示,Blebbistatin处理并未明显改变成骨细胞的铺展面积(图5),但显著增加了MM50CH50表面成纤维细胞的铺展面积,这支持了降低成纤维细胞的细胞内力将促进其在暴露RGD基序较少的聚合物表面黏附的假设(图5)。Calyculin A处理会增加肌球蛋白II 的活性和细胞内力,导致MM50CH50表面的成骨细胞和成纤维细胞的铺展面积均显著减小(图5),这与前面提到的结论相呼应,即由于MM50CH50表面吸附蛋白暴露的 RGD 基序不足,无法结合整合素并平衡细胞内力的增加,从而损害了细胞铺展。

图6. 成骨细胞和成纤维细胞的优选聚合物表面的增殖、迁移和共培养
为了评估成骨细胞选择性β-氨基酸聚合物MM50CH50的功能,他们研究了成骨细胞在MM50CH50表面的生长、迁移和成骨细胞与成纤维细胞的共培养行为。结果表面优选聚合物具有良好的促成骨细胞增殖、迁移和优异的体外选择性黏附效果。

图7. 体内骨整合效果
由于牙科植入物位于口腔内,植入物的早期骨整合和预防无菌性松动至关重要。因此,他们选择SD大鼠口腔植入模型进行概念验证,以进一步探究成骨细胞选择性β-氨基酸聚合物MM50CH50的潜在应用。植入8周后,MM50CH50修饰的钛螺钉界面与周围骨组织直接接触,实现了良好的整合(BIC%为 85.5%±7.1%);而未涂层的钛螺钉,新骨与界面之间存在纤维结缔组织(BIC%为32.8%±10.5%),这阻碍了骨整合。无选择性的聚合物、RGD和KRSR修饰的钛螺钉的BIC%分别为60.5%±7.8%、53.8%±10.5%和42.3%±7.0%,介于MM50CH50修饰的钛螺钉和未涂层组之间(图7b)。在其他研究中,最佳组的BIC% 通常在50-70%之间。三维Micro-CT图像反映的结果与组织学染色分析一致(图7c)。MM50CH50修饰的钛植入物周围的骨体积/总体积(BV/TV)值、骨小梁数量(Tb.N)和骨小梁厚度(Tb.Th)通常高于未涂层的钛螺钉;而MM50CH50修饰的钛植入物周围的骨表面/骨体积(BS/BV)和骨小梁间距(Tb.Sp)则低于未涂层的钛螺钉(图7)。这些观察结果表明,MM50CH50修饰的钛植入物得益于MM50CH50对成骨细胞与成纤维细胞的选择性,在体内与周围骨组织实现了良好的整合,这与体外实验中其对成骨细胞的选择性表现一致。
华东理工大学陈琦特聘副研究员是该论文的第一作者,刘润辉教授为通讯作者。该研究得到了国家科学基金委等基金资助。
论文链接:https://www.nature.com/articles/s41467-025-58394-1
- 天津大学潘莉团队《Macromolecules》:中等立构/区域选择性催化剂设计高性能聚丙烯基弹性体 - 助力iPP增韧与HDPE/iPP共混物高效增容 2026-02-10
- 海南大学黄玮/张明鑫团队 JACS:浓盐水直接分离 2026-02-09
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
- 华东理工大学刘润辉教授课题组在促细胞粘附新材料领域获得突破:设计和发现双重机理的促细胞粘附β-氨基酸聚合物 2021-01-26
- 西安交大卢同庆教授团队《Sci. Adv.》:生物黏附界面设计实现膨体聚四氟乙烯医用植入物的即时牢固固定 2025-06-24
- 四川大学梁坤能、邓怡 ACS Nano:用于感染性骨缺损快速杀菌与骨整合的非氧依赖型硫酸根自由基和Fe2+修饰植入物 2025-05-16
- 川大梁坤能副教授和邓怡研究员团队 Small:糖尿病植入相关感染的新疗法 - 级联放大治疗能力的多功能生物异质结酶工程植入物 2025-01-04
