由于新陈代谢、局部血流等的差异,肿瘤组织具有与正常组织不同的特殊微环境,这种特殊微环境不仅为病变组织的进一步发展和恶化提供了土壤,还能保护病变组织免受免疫系统和药物的伤害,已成为影响药物疗效的关键共性问题。针对肿瘤组织的特殊微环境,浙江大学计剑、金桥研究团队在前期工作中设计了一系列肿瘤微环境敏感的智能纳米载体(Small, 2016, 12, 6223-6232; ACS Nano, 2017, 11, 1281-1291; Small, 2018, 14, 1802420;Biomaterials, 2018, 187, 55-65),并基于该系列工作受邀在ACS Nano上发表综述性论文“Rational Design of Cancer Nanomedicine for Simultaneous Stealth Surface and Enhanced Cellular Uptake”(ACS Nano, 2019, 13, 954-977)。
在此基础上,研究团队进一步拓展了针对肿瘤微环境的纳米载体的设计理念,通过“利用”和“改造”肿瘤微环境的设计策略,创建了一系列针对肿瘤微环境的功能纳米载体材料,取得了系列研究进展:
一、利用肿瘤组织过表达的酶实现超分子AIE点的程序性靶向,用于胰腺癌的诊断和治疗
纳米药物载体长效循环与细胞选择性内吞之间的矛盾是影响纳米药物疗效的一大关键科学问题。由于肿瘤组织中基质金属蛋白酶(MMP)是高表达的,研究团队与南开大学丁丹教授合作,将MMP敏感的多肽引入到纳米载体的设计中,构建了具有程序性靶向特性的超分子AIE点,实现了MMP敏感的肿瘤组织靶向富集和肿瘤细胞选择性内吞。该超分子纳米载体被成功用于原位胰腺癌的诊断和治疗,并利用超分子AIE点实现了吉西他滨纳米载体的体内可视化。相关研究成果以“Supramolecular Aggregation-Induced Emission Nanodots with Programmed Tumor Microenvironment Responsiveness for Image-Guided Orthotopic Pancreatic Cancer Therapy”为题发表在ACS Nano(2020, 14, 5121-5134)上,第一作者为博士生陈晓辉和高贺麒,通讯作者为金桥副教授和丁丹教授。

二、利用肿瘤组织酸性微环境实现一氧化氮纳米载体的线粒体靶向递送,克服肿瘤的耐药和转移
肿瘤的耐药和转移都需要ATP的参与,与线粒体息息相关。一氧化氮能作用于线粒体影响细胞ATP的合成。研究团队设计了肿瘤组织微酸环境敏感的阿霉素和一氧化氮共传递的纳米载体,通过肿瘤组织微酸环境激活线粒体靶向肽,利用一氧化氮的线粒体靶向递送减少了细胞ATP的产生,进一步通过抑制耐药相关蛋白P-gp的表达逆转了肿瘤的耐药性。另一方面,一氧化氮还通过抑制肿瘤相关微泡的产生抑制了肿瘤的转移,相关研究成果以“ATP Suppression by pH-Activated Mitochondria-Targeted Delivery of Nitric Oxide Nanoplatform for Drug Resistance Reversal and Metastasis Inhibition”为题发表在Small(2020, in press, DOI: 10.1002/smll. 202001747)上,第一作者为博士生邓永岩和贾凡,通讯作者为金桥副教授和计剑教授。

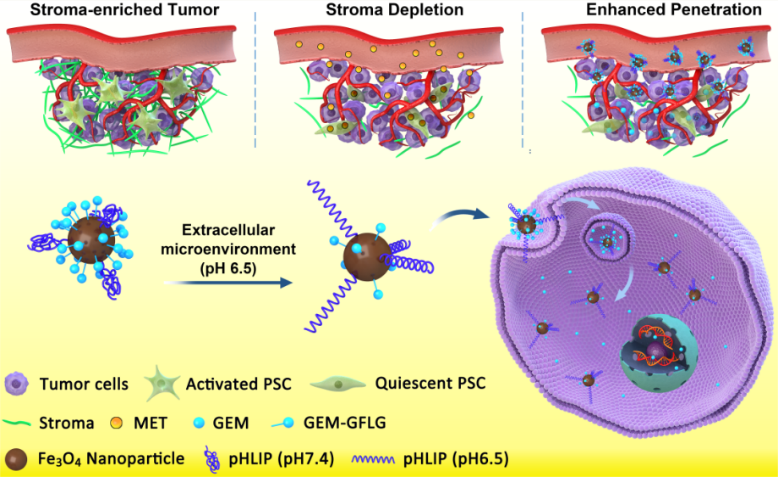
三、利用二甲双胍改造肿瘤致密基质微环境,促进药物渗透,实现胰腺癌的靶向治疗
胰腺癌是最致密的实体肿瘤。胰腺肿瘤中的致密基质严重影响药物和纳米粒子在肿瘤中的渗透。针对这一关键问题,研究团队与中科院化学所的高明远研究员合作,提出了联合二甲双胍实现靶向递送吉西他滨纳米载体的新策略。研究发现,二甲双胍可通过胰腺癌细胞的AMPK途径,下调纤维化细胞因子TGF-β的表达,从而抑制胰腺星状细胞的活性,使胰腺星状细胞的基质相关蛋白α-SMA和胶原的表达量大大降低,进而有效抑制了肿瘤基质的生成,有效提高了键合吉西他滨的磁性纳米粒子在肿瘤组织中的渗透性,并通过原位胰腺癌模型证明该设计能极大提高胰腺癌化疗的疗效。该研究不仅为胰腺癌治疗提供了全新的思路,也进一步拓宽了二甲双胍的生物医学应用,相关研究成果以“Metformin-Induced Stromal Depletion to Enhance the Penetration of Gemcitabine-Loaded Magnetic Nanoparticles for Pancreatic Cancer Targeted Therapy”为题发表在JACS(2020, 142, 4944-4954)上,第一作者为韩海杰、侯毅和陈晓辉,通讯作者为金桥副教授和高明远研究员。
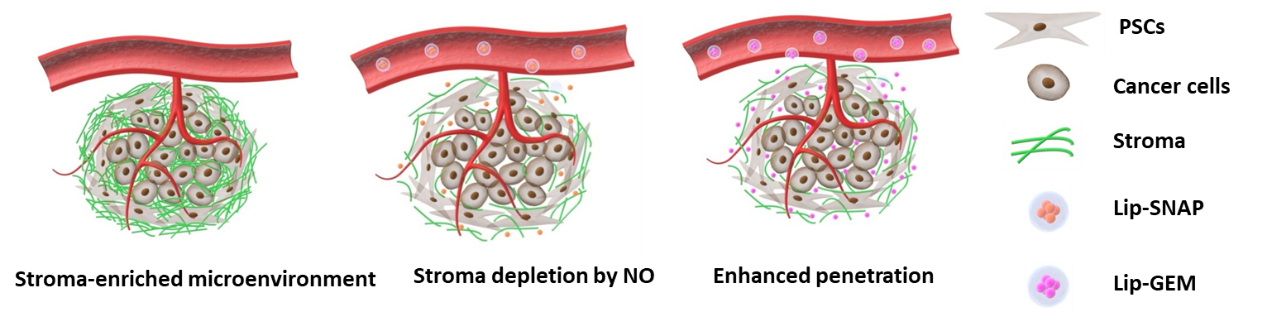
四、利用一氧化氮抑制肿瘤基质的生成,增强化疗的疗效
为了破坏胰腺肿瘤的致密基质微环境,提高药物在肿瘤中的渗透性,研究团队进一步和浙二医院合作,利用脂质体装载的一氧化氮供体抑制胰腺星状细胞的Smad2信号通路,减少了肿瘤基质相关蛋白α-SMA和胶原的生成,有效减少了肿瘤基质的生成,提高了负载吉西他滨的脂质体在肿瘤中的渗透性,并通过皮下和原位胰腺癌小鼠模型证明了该两步法递送策略能有效抑制肿瘤的生长,相关研究成果以“Nitric Oxide-Induced Stromal Depletion for Improved Nanoparticle Penetration in Pancreatic Cancer Treatment”为题发表在Biomaterials(2020, 246, 119999)上,第一作者为博士生陈晓辉和贾凡,通讯作者为金桥副教授和刘维峰医师。
论文链接:
https://pubs.acs.org/doi/10.1021/acsnano.0c02197
https://doi.org/10.1002/smll. 202001747
https://pubs.acs.org/doi/10.1021/jacs.0c00650
https://www.sciencedirect.com/science/article/pii/S0142961220302453
- 福大林立森/新国大陈小元 Nature大子刊:当手性水凝胶遇上细胞膜仿生-可术后空腔植入的生物杂化水凝胶如何调节肿瘤干细胞信号 2025-12-30
- 苏州大学冯良珠教授、刘庄教授团队 AFM:温敏催化水凝胶助力酶触“破膜+氧化应激”级联肿瘤消融新策略 2025-12-04
- 四川大学丁明明/薛建新《Adv. Mater.》:铜驱动变构自封装聚合物用于肿瘤特异性成像和治疗 2025-10-13
- 上海理工大学宋文良/余灯广:聚苯丙氨酸与聚(3,4-二羟基-L-苯丙氨酸)- 用于构建刺激响应纳米载体的潜在生物医学材料 2024-09-18
- 青大胡浩、于冰/北化徐福建团队 Biomaterials:负载多聚脱氧核糖核苷酸纳米载体的近红外响应水凝胶用于增强慢性伤口愈合 2024-09-04
- Daniel Siegwart/董一洲/陶伟教授 Nature Reviews:基于纳米技术的mRNA疫苗 2023-09-08
