恶性肿瘤是严重威胁人类健康的重大疾病,目前除传统的手术、 放疗和化疗外,还建立了一系列肿瘤治疗新方法/策略如生物治疗、免疫治疗、物理治疗(如热、光、磁、电、超声)和动力学治疗等。但是由于肿瘤干细胞以及复杂的肿瘤微环境影响,中晚期治疗困难和复发等成为肿瘤治疗中难以克服的障碍。如果将不同治疗方法结合在一起协同治疗肿瘤会取得更好的综合疗效。将两种或多种不同方法(双模和多模态)协同治疗肿瘤,不仅疗效高(20天抑制瘤率超过90%)、毒副作用小,而且使用药量低、功能拓展性强。研究结果表明肿瘤协同治疗效果明显优于单种治疗方法,但是因为肿瘤复发和中晚期治疗困难,目前很少有协同治疗方法能够达到临床治疗的要求。为更接近临床肿瘤复发和中晚期治疗的现状,近来研究人员将肿瘤在老鼠皮下长到300 mm3以上形成大肿瘤模型,其体积大、生长旺盛,治疗难度更大。将肿瘤模型长时间(40-80天)观察其复发情况作为疗效的评判标准能更好地评价肿瘤协同治疗效果。
热动力疗法(Thermodynamic therapy,TDT)是近几年来发展起来的一种新型动力学治疗方法,其特点是利用热激活动力剂产生活性自由基杀灭肿瘤而不依赖于肿瘤的环境,目前主要使用的热动力剂是2,2''-偶氮双[2-(2-咪唑啉-2-基)丙烷]二盐酸盐(2,2’-azobis[2-(2-imidazolin-2-yl)propane]dihydrochloride,AIPH),该化合物热不稳定(40-50℃)分解放出自由基,一般需要负载于载体上进入体内。加热方法有光,磁加热等。理想的热动力控温条件应该使治疗部位保持40-65℃较长的时间(大于10分钟),过热会造成AIPH分解。因此这些加热方法与热动力剂的匹配性不好,还没有专门用于热动力治疗的加热系统。他们针对肿瘤热/热动力控温要求,在多物理场仿真结果的指导下,利用微纳加工技术如激光刻蚀等,研发了一系列热动力治疗专门用微电热针,经过优化设计了一种单回路微电加热针,利用激光技术在中空针体壁打孔将导线引出形成回路(图1 上)。该微电热针可在0.2-2 V的低电压下实现动物体内1分钟快速升温且发热位置可调整,能实现定长精确发热控温,特别适用于肿瘤物理热疗/热动力治疗。动物实验表明60 s内小鼠肿瘤部位温度从34.7 ℃升高至53.8 ℃,加热20 s肿瘤温度就达到50 ℃,加热2 min温度达到稳态,肿瘤最大温度约65 ℃,可在2 V低电压下肿瘤局部40~65℃范围维持特定温度T±7℃ 20分钟以上(图1 下)(中国专利ZL202010490961.0)。
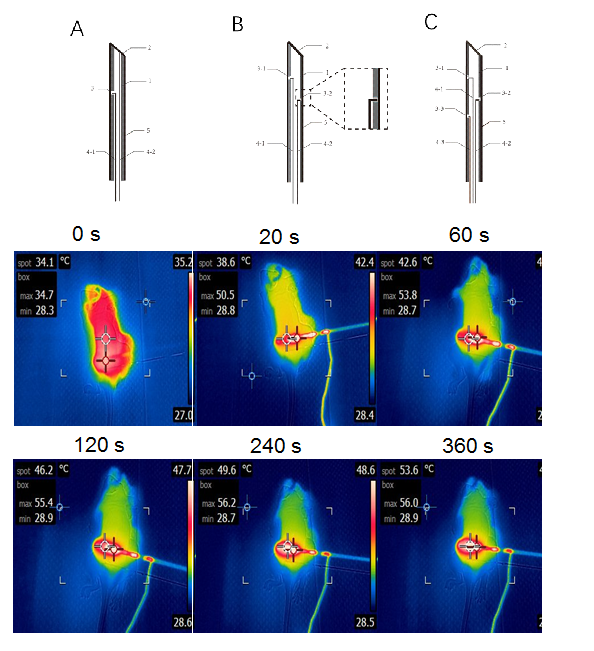
图1.微电热针的结构与性质
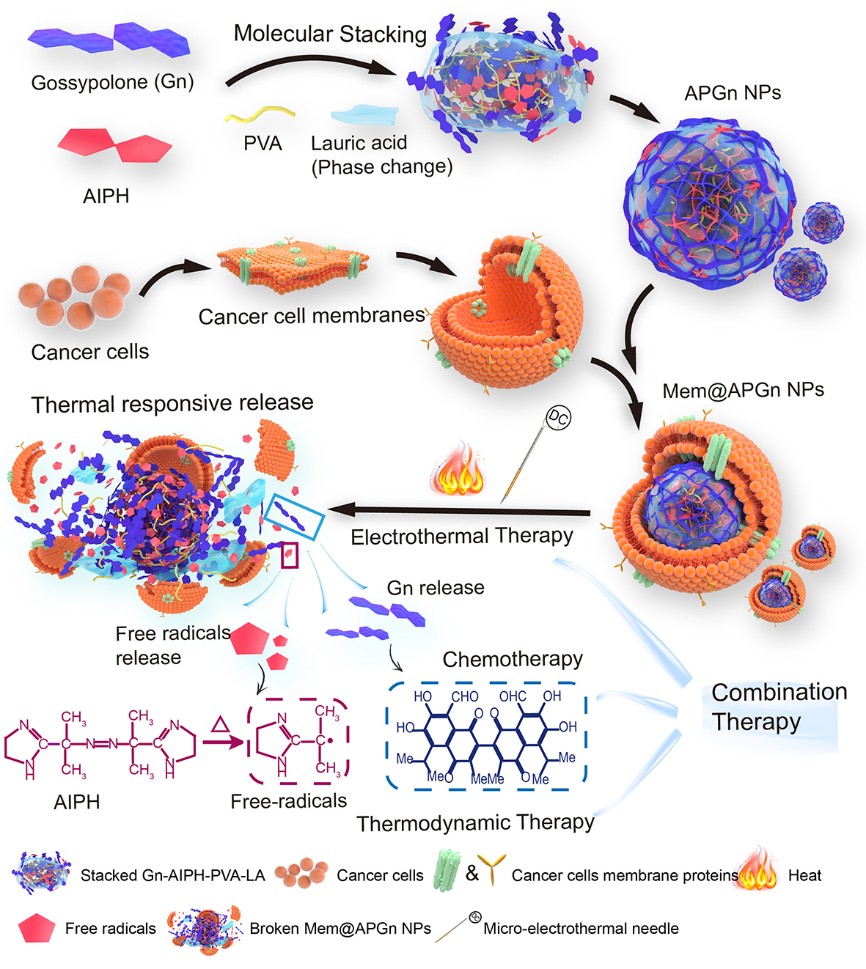
图2.大肿瘤电热/热动力/化疗三模态协同治疗
APGn@MemNPs进入体内后利用同源肿瘤细胞膜靶向到肿瘤部位,在微电热针加热下热疗的同时,月桂酸迅速相变释放AIPH,产生大量自由基杀灭肿瘤,而Gn的释放相对缓慢用于长期化疗。这种将短期电热/热力学治疗与长期化疗相结合的策略可以最大限度地发挥不同治疗方法的疗效,对于大肿瘤(30mm3)综合治疗效果显著。

如图3A所示PBS组的肿瘤显著增长(16天的平均体积超过1200 mm3)。Mem@APGn单一剂量的NPs对肿瘤生长有轻微的抑制作用。Gn和AIPH的(5 mg kg?1)治疗组肿瘤的生长仅在给药后几天内受到限制。早期给药可以有力地减缓肿瘤的进展,这与临床经验的结果一致。在单独的ETT(H)组中观察到明确的肿瘤生长抑制。H1(100 mm3模型)的肿瘤抑制作用与H3(在300 mm3模型)相似,肿瘤抑制率TIR接近90%。此外Mem@APGn温度控制组NPs(Mem@APGnNPs+H)在处理100和300 mm3肿瘤方面显示出同等的疗效。其16天肿瘤抑制率TIR分别为96.97%和99.89%(图3B)。图3C显示了H1、和H3中的一些肿瘤复发情况,Mem@APGnNPs+H3组60天肿瘤复发率仅20%。上述结果显示了该方法优异的大肿瘤治疗效果,在未来的肿瘤治疗中具有广阔应用前景。
该研究成果日前以 “Molecular Stacking Composite Nanoparticles of Gossypolone and Thermodynamic Agent for Elimination of Large Tumor in Mice via Electrothermal-Thermodynamic-Chemo Trimodal Combination Therapy”为题在国际著名学术期刊“Advanced Functional Materials” (IF=18.8)上在线发表,第一作者为西安交通大学生命学院博士生刘怡茗,吴道澄教授为唯一通讯作者,西安交通大学生物医学信息工程教育部重点实验室和生命学院为该论文的第一和唯一通讯作者单位。该研究成果是吴道澄教授课题组在无限配位聚合物联合化疗治疗肿瘤(Int J Nanomedicine 2017,12; 4085–4109,连续3年 ESI高被引论文)、肿瘤光热化疗(Biomaterials 2018, 154;197-212)和光热/无限配位聚合物双药协同肿瘤治疗(Advanced. Functional. Materials 2021,31(24); 2100954)之后的又一重要成果。
该工作得到了国家自然科学基金和国家重大科学仪器设备项目的资助。西安交通大学分析测试中心为本工作提供了大量测试表征支持。
论文链接:https://doi.org/10.1002/adfm.202201666
- 吉林大学钱虎军教授团队 PRL:单链纳米粒子突破高分子材料“强度-韧性-加工性”三难困境 2025-10-15
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
- 华工殷盼超/广工尹家福团队 Nano Lett.:软纳米粒子多时空动力学解析 2025-08-21
- 武汉大学陈朝吉/四川大学张伟 ACS Nano:仿生梯度水凝胶电解质界面优化构筑稳定锌离子电池 2025-07-21
- 广工高粱课题组 Adv. Mater.: 基于聚乙烯醇缩醛相变液体的全季节非对称热致变色窗 2025-06-03
- 华南理工大学郭建华教授团队 AFM:可多层组装泡孔结构的聚乙烯醇/碳复合气凝胶实现宽带微波噪声双吸收和水下形状记忆效应 2025-05-14
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
