西南交大鲁雄/谢超鸣团队《Bioact. Mater.》:具有免疫调节能力的聚多巴胺介导氧化石墨烯和纳米羟基磷灰石复合电活性支架加速糖尿病牙周骨再生
2022-04-18 来源:高分子科技
在糖尿病条件下的牙周骨缺损修复再生是一个巨大的挑战。贻贝启发的聚多巴胺(PDA)在材料和生物科学领域具有巨大的科研和应用价值。PDA修饰的纳米颗粒具有良好的水分散性、生物相容性和细胞粘附性。PDA是一种很有前途的抗氧化剂,通过清除活性氧和下调炎症介质来降低氧化应激,保护细胞免受过量活性氧的毒性影响。同时,PDA具有免疫调节能力。
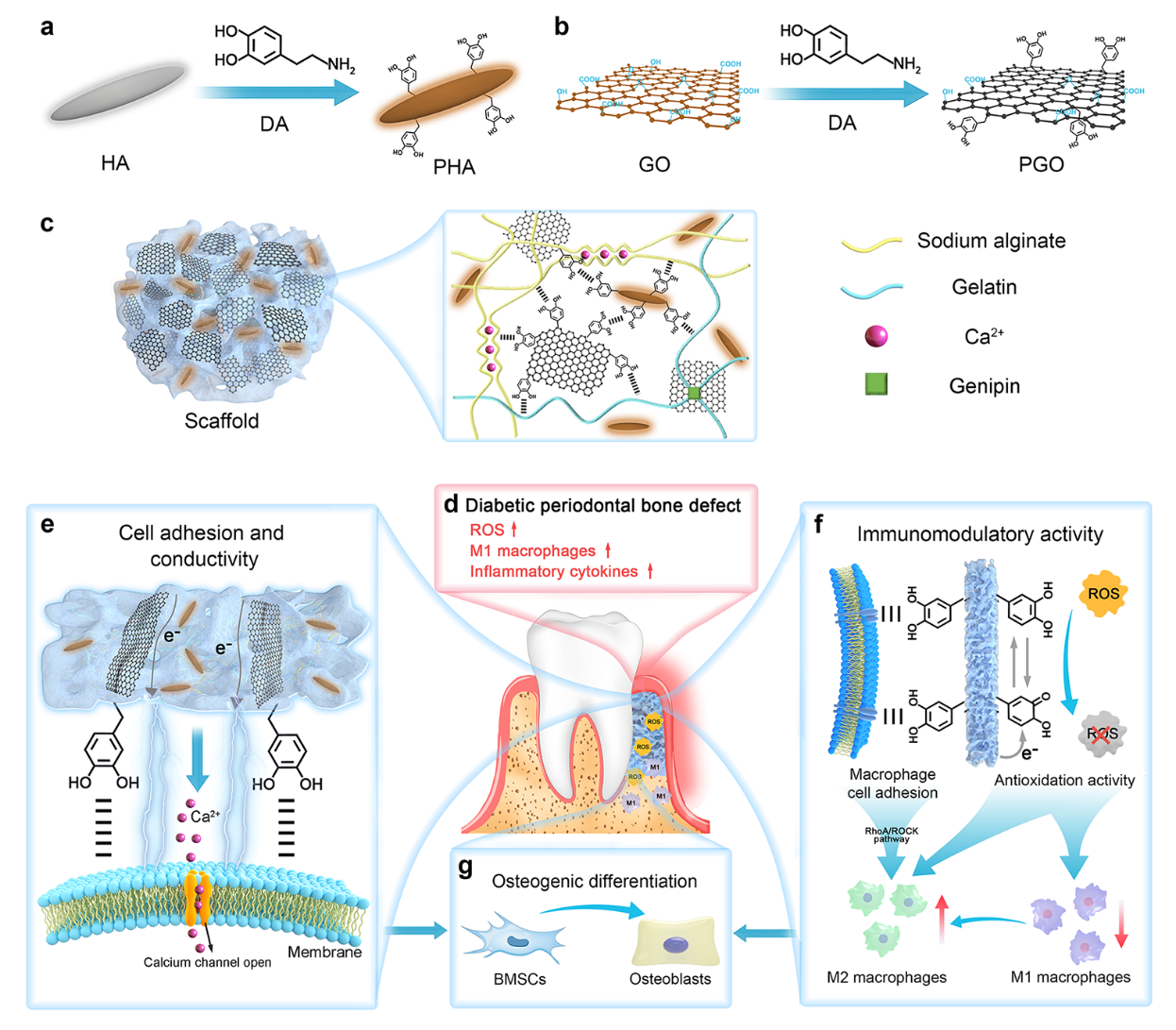
图1 用于糖尿病牙周骨缺损再生的具有多功能特性的PGO-PHA-AG支架合成示意图。(a)PHA合成示意图。(b)PGO合成示意图。(c)物理化学双交联PGO-PHA-AG支架网络中的相互作用方式。(d)糖尿病牙周微环境中ROS、M1型巨噬细胞和炎性因子过度表达。(e)该支架促进细胞粘附,将内源性电信号传递给细胞,进而激活钙离子通道。(f)PDA的细胞粘附能力和ROS清除能力赋予支架免疫调节能力,降低巨噬细胞向M1型方向极化,促进巨噬细胞向M2型巨噬细胞方向极化并分泌成骨相关细胞因子。(g)支架的电活性和免疫调节能力协同促进糖尿病牙周骨缺损再生。
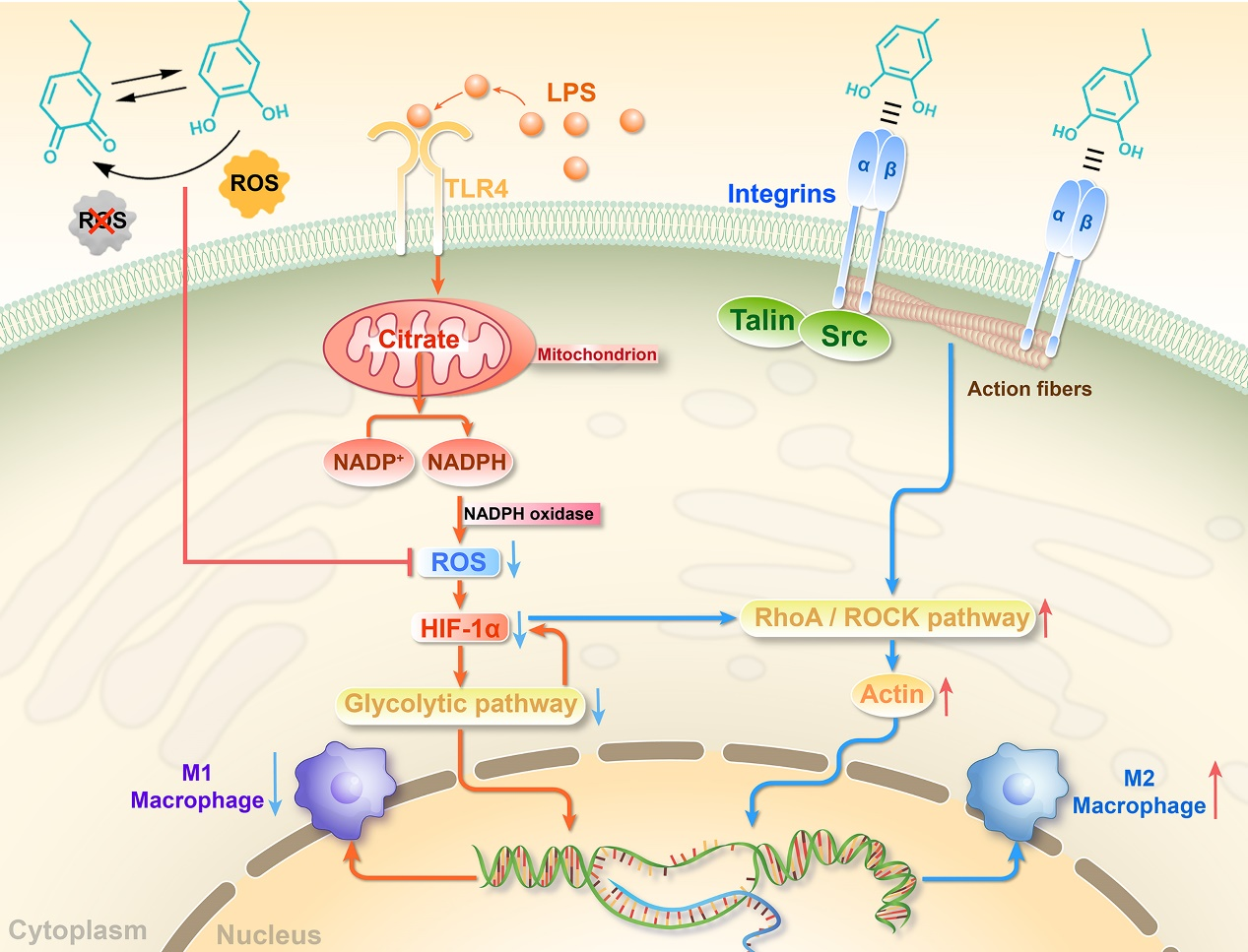
图2 PGO-PHA-AG支架上巨噬细胞极化机制示意图。
该项成果以”Polydopamine-mediated graphene oxide and nanohydroxyapatite-incorporated conductive scaffold with an immunomodulatory ability accelerates periodontal bone regeneration in diabetes”为题在线发表于《Bioactive Materials》。论文第一作者为四川大学华西口腔医学院在读博士研究生李亚祯,通讯作者是西南交通大学的鲁雄教授、谢超鸣研究员团队、四川大学华西口腔医院的赵志河教授和王军教授团队。论文第一单位为四川大学华西口腔医学院。该研究得到了国家自然科学基金、四川大学华西口腔医院探索与研发项目等基金支持。
论文链接:https://www.sciencedirect.com/science/article/pii/S2452199X22001384
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 西南大学曾建兵《Macromolecules》:聚多巴胺辅助构建高性能室温自修复导电弹性体 2025-10-19
- 新疆大学吐尔逊·阿不都热依木教授团队 CEJ: 聚多巴胺-PEDOT基便携式传感器用于氯丙嗪和诺氟沙星的同步测定 2025-09-05
- 新疆大学吐尔逊·阿不都热依木教授团队 AFM:利用3D Ti3C2Tx 混合电极材料增强电化学储能 2025-07-31
- 武汉大学陈朝吉/四川大学张伟 ACS Nano:仿生梯度水凝胶电解质界面优化构筑稳定锌离子电池 2025-07-21
- 华南农大杨卓鸿/胡洋、阿尔伯塔大学曾宏波 CST: 基于香草醛固化剂和改性氧化石墨烯的高强度、耐老化、可回收环氧防腐涂层 2025-07-11
- 四川大学王延青 AFM:氧化石墨烯纳米片协同双工程设计硬碳 - 边缘钝化与催化SEI设计以实现超高初始库仑效率钠离子电池 2025-07-10
- 川大孙勇研究员/樊渝江教授课题组 AM:具有指导性生态位的工程化微通道支架通过调节CSF-1/CSF-1R通路促进内源性骨再生 2024-03-01
