创伤、手术、凝血障碍等造成的大出血是威胁人类生命的主要因素。据统计,在日常生活场景下发生创伤后,大出血会导致43%的死亡,而在战场上死亡率则高达90%。 当大出血发生于肺部或腹部的内脏、大血管、骨盆等位置时, 常规的按压止血将无法实施。诸如此类的“不可压迫性大出血”特别危险,目前临床上只能通过输血和手术方法来治疗。近年来,止血生物材料经历了前所未有的发展,已广泛用于术前紧急出血控制、术中辅助常规止血、术后促进伤口愈合等各个阶段。这些材料通过静脉注射或者腔内注射的方法递送至出血点,或增强机体自身凝血机制,或独立形成物理性屏障,来达到快速止血的目的。此类材料有望大大提高生存机率,加速术后愈合,整体改善患者的康复水平。
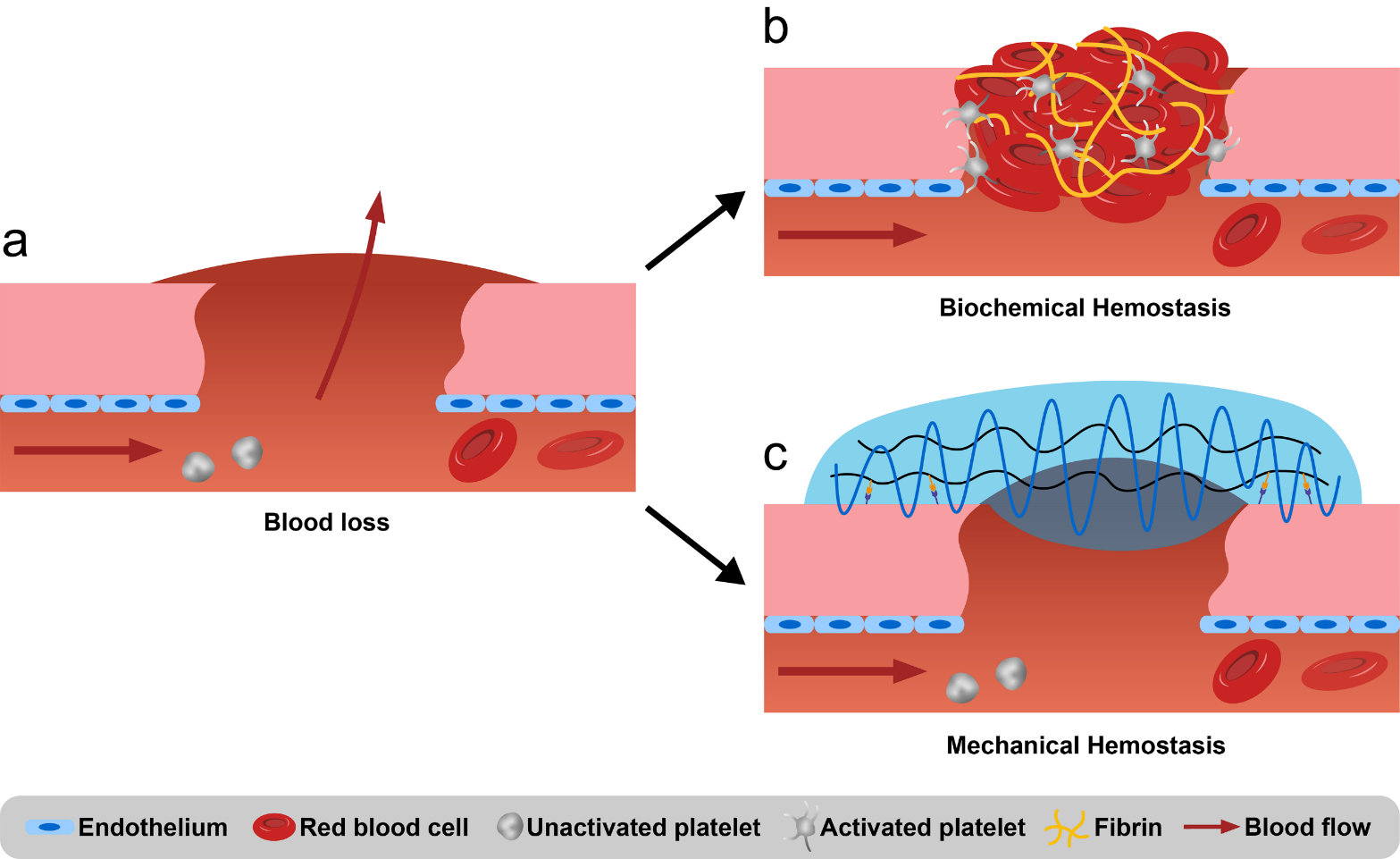
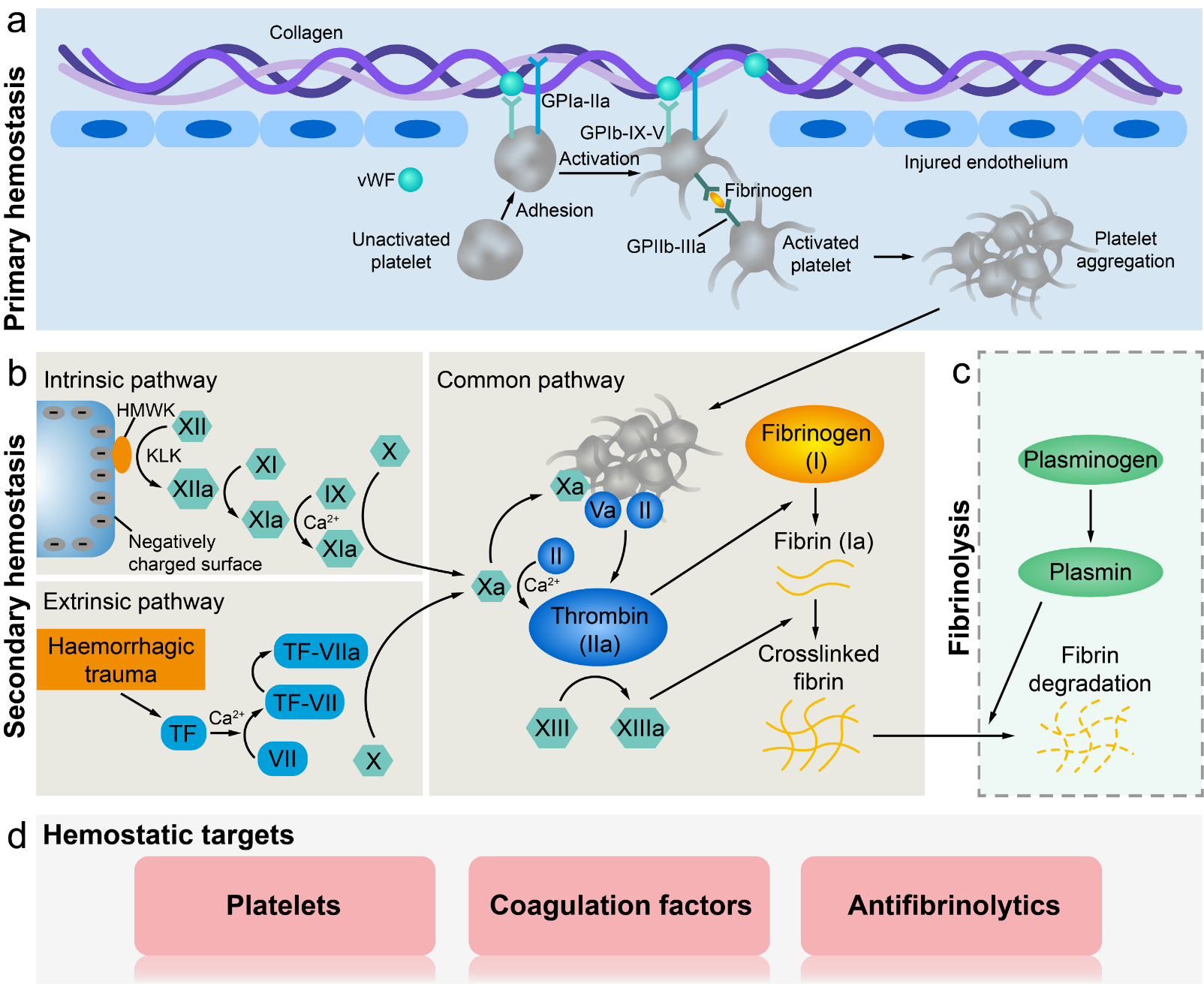
但是上述生物化学止血剂依赖于人体自身的凝血系统来发挥止血作用,这对于存在原发性和继发性凝血障碍的患者形成了极大的挑战。另外生物化学制品通常存在保存条件苛刻、保质期短、价格昂贵、潜在的交叉感染和免疫原性等问题。因此,独立于机体自身凝血系统的机械止血剂近年来得到了长足的发展。这些止血材料通过与血液和组织相互作用,于出血处形成稳固的物理性屏障,防止血液流出。按照其施加机械力的不同,机械止血材料可以大致分为三类:吸收型、凝集型和粘附型。部分止血材料同时包含上述多种止血机制。
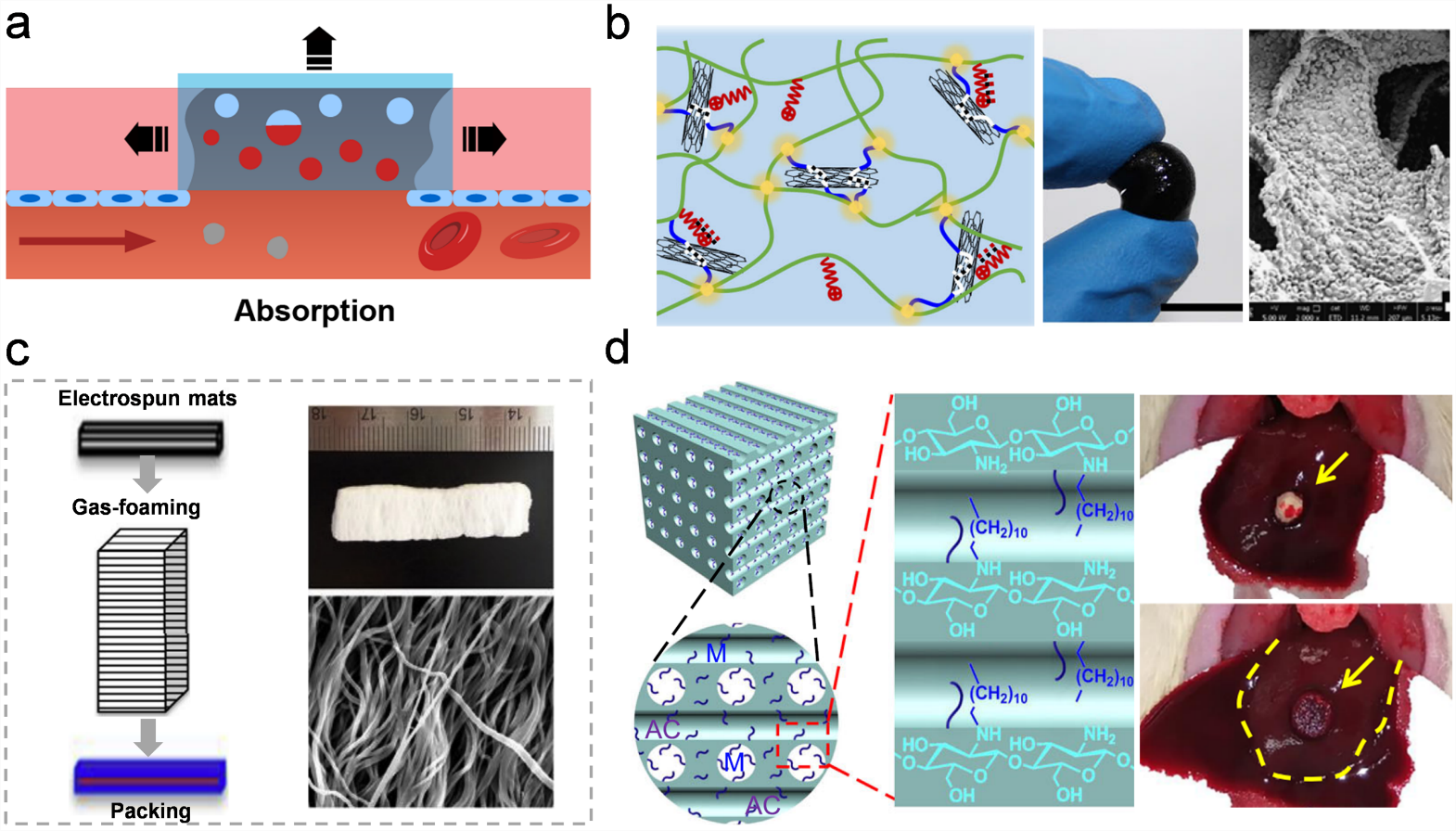
吸收型止血材料通常由亲水聚合物制备而成,结构上含有相互连通的孔道(图3)。这种多孔结构可以通过冷冻凝胶法、冻干法、气体发泡法、模板浸出法等方式形成。化学性质和物理结构的结合使得该类材料能够快速吸收血液中的水分,从而浓缩血液中的细胞和蛋白质成分,促进凝血。材料在吸收了大量水分后会体积膨胀,在出血位置形成填塞效应,对组织产生了一定的膨胀压力,防止血液流出。此外,多孔材料的微米级孔道能够促进并引导细胞浸润、营养物质交换,从而改善后续的伤口愈合。
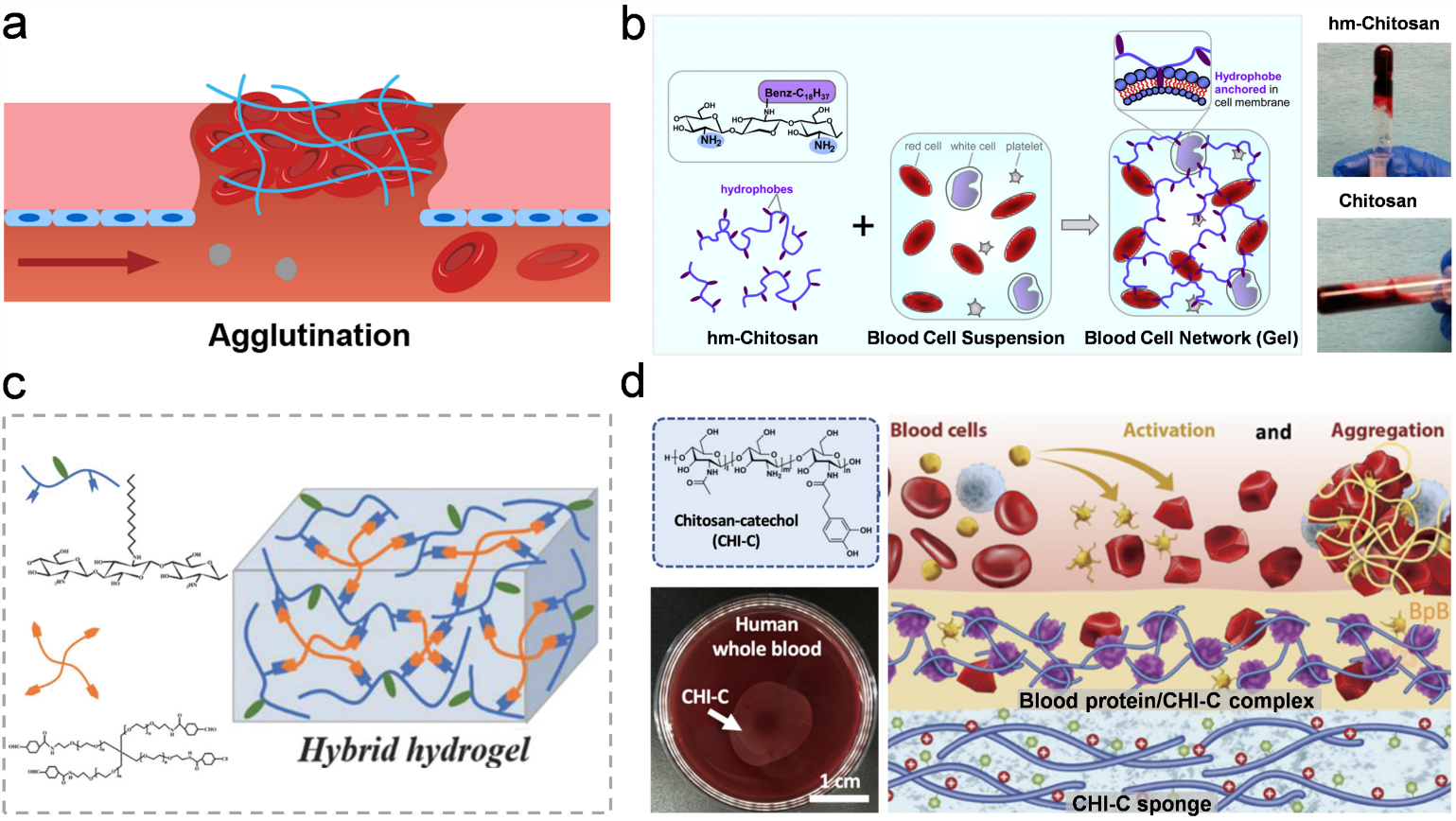
凝集型止血材料通过生物材料和血液成分(如红细胞、蛋白质)相互作用使血液凝固(图4)。该策略不同于人体自身的凝血级联反应造成的血液凝固,因此更适用于患有凝血障碍的患者。能够诱导血液凝固的作用力包括静电相互作用、疏水相互作用等。其中最具代表性的聚合物是壳聚糖,它能通过自身的正电荷吸引带负电荷的红细胞,从而导致血液凝集。然而由于静电相互作用力较弱,形成的血液凝块力学性质较差,不利于有效止血。一种解决方案是在壳聚糖长链上修饰疏水基团,这些基团能够通过疏水作用嵌入细胞膜,从而交联血液细胞,形成更加稳固的血液凝块。另一种方法是在壳聚糖上修饰邻苯二酚基团,该官能团协同正电荷能够和血液中的蛋白质或者细胞发生多重相互作用,快速生成血液-材料复合物膜,形成止血屏障。
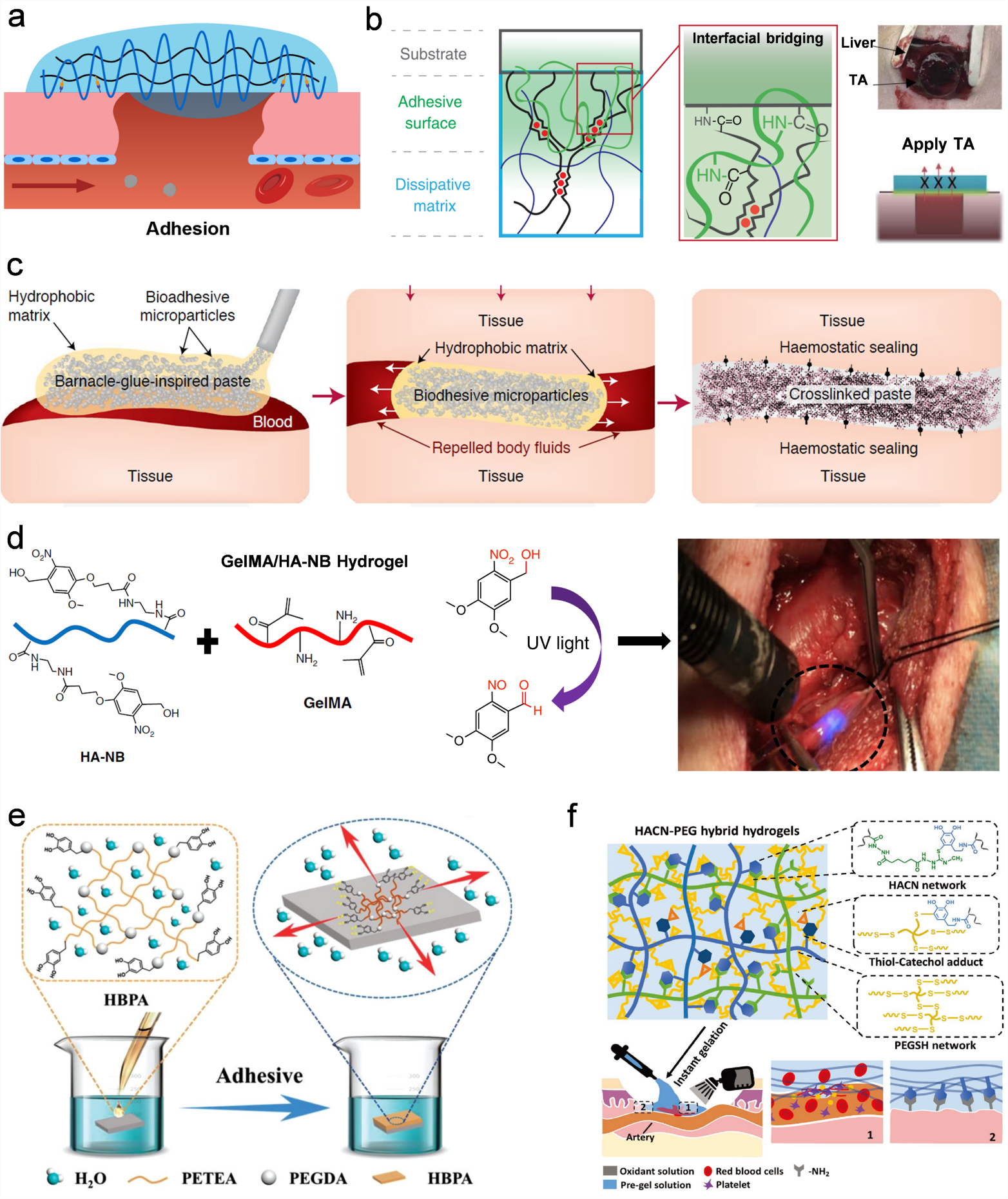
得益于近年来生物粘合剂的快速发展,粘附型止血材料得到了广泛的研究和应用(图5)。此类材料能够通过和组织形成共价键或者非共价相互作用粘附于组织表面,从而密封伤口,提供机械性止血屏障。按照粘附性化学官能团的不同,此类材料可分为三种:N-羟基琥珀酰亚胺酯类、醛基类和邻苯二酚类。其中第一种已经制成商业化试剂并广泛应用于临床,但是其粘附性能较弱,针对这一问题,作者课题组前期研究的超韧粘合剂能够将粘附性能提升100倍以上,粘附强度媲美软骨和骨之间的牢固连接。醛基类粘附止血材料存在醛基修饰复杂且不稳定等问题,因此光引发醛基生成材料显示出了良好的前景。最后一种是基于多功能的邻苯二酚基团(贻贝仿生化学)。通过聚合物分子设计,邻苯二酚类止血剂在血液、体液存在的情况下仍能有效粘附于组织表面,甚至能够在胃部酸性条件下形成粘附,实现了良好的止血性能。
文章结尾作者指出,在设计止血材料时,应根据目标应用场景设计相关功能,从而满足术前、术中、术后各个阶段的不同止血需求。从临床转化角度来讲,止血材料的安全性、监管批准、成本、大规模生产等应作为考虑因素。另外,作者讨论了该领域现存的挑战,主要包括血块力学的知识缺口、体外测试和体内表现的差异、以及标准化动物模型的建立。最后,作者展望了止血材料未来的发展机遇,包括人造血小板的功能设计、血块力学性质增强策略、以及止血材料促进组织修复和免疫调控等功能的设计。
该工作的第一作者是麦吉尔大学机械系博士生蒋帅兵,通讯作者是麦吉尔大学加拿大研究讲席教授李剑宇。研究得到了新领域研究基金、加拿大卫生研究院和加拿大自然科学和工程研究理事会的资助。
论文链接:https://doi.org/10.1039/D2TB00546H
近年来,李剑宇团队致力于生物材料和生物力学研究,发表了一系列工作。与该文章相关的凝血和止血的文章包括:
- 关于凝血块的断裂力学研究: Shiyu Liu, et al. Extreme Mechanics Letters, 101444, 48 (2021). https://doi.org/10.1016/j.eml.2021.101444
- 凝血块的粘弹性和多孔弹性的研究:Farshid Ghezelbasha, et al. Journal of the Mechanical Behavior of Biomedical Materials, 105101, 128 (2022). https://doi.org/10.1016/j.jmbbm.2022.105101
- 组织粘附剂的进展报告: Zhenwei Ma, et al. Advanced Materials 33 (24), 2007663 (2021). https://doi.org/10.1002/adma.202007663
下载:Hemostatic biomaterials to halt non-compressible hemorrhage
- 华东师大张强研究员课题组《Small》:开发新型纳米多孔沸石/纳米纤维素复合气凝胶止血材料 2025-04-21
- 西安交大郭保林教授课题组 Nano Today:集止血、透气、促修复及监测四位一体的智能鼻腔止血材料 2023-01-08
- 西安交大郭保林教授《Nat. Rev. Chem.》邀请综述:用于伤口愈合应用的止血材料 2021-09-29
- 武汉纺织大学于志财/何华玲团队 Carbohyd. Polym.:海藻酸盐基多功能多孔材料 - 可“火灾预警”的智能保温防护甲 2025-04-13
- 浙江大学唐睿康教授、刘昭明研究员团队 Small:有机-无机有序共聚策略用于轻质高强多孔材料制备 2024-09-29
- 空军军医大学白永康/桂林理工李裕琪 CEJ:在多响应形状记忆驱动和自供电传感集成化材料方面取得新进展 2023-11-06
- 陕科大王学川/党旭岗、温州医科大郑漫辉 AFM:可注射自修复生物质基水凝胶生物粘合剂用于伤口愈合和可穿戴生物电子一体化 2026-01-30
