细菌感染是伤口处理过程中存在的主要问题。由于抗生素的长期使用与滥用,细菌耐药性不断提高,探索替代抗生素的应对细菌感染的有效治疗策略尤为关键。纳米酶,一类具有类酶活性的纳米尺寸的材料,具有低成本、高催化活性以及易于调控的优势,可作为替代抗生素的新型抗菌药物,在伤口消毒领域具有极大的应用前景。近年来,氮掺杂的碳基纳米酶因其优异的光热性能与催化活性,已在生物医学领域引起广泛关注。其中,碳点(CDs),一种尺寸小于10 nm的零维碳基纳米材料,由于其优异的光学性能、催化性能和生物相容性,在抗菌治疗领域表现出巨大潜力。然而,CDs内部的电子转移效率较低,类酶的催化效率有限,限制了其在生物医学领域的进一步推广与应用。为改善CDs内部电子环境,杂原子掺杂策略被提出。最近研究表明,在类过氧化物酶(类POD)催化过程中,铁掺杂碳基纳米酶具有更高的活性中心利用率,能催化H2O2产生更多的·OH。且铁掺杂碳纳米酶表现出比其他金属(即Mn、Co、Ni、Cu)掺杂的碳纳米酶更高的类酶活性。此外,在近红外(NIR)区域具有强吸光性质的CDs还可作为光热疗法(PTT)的光热剂,并有望通过热场促进电子转移效率,从而增强类酶活性,实现高效的协同抗菌治疗。
有鉴于此,军事科学院军事医学研究院周冬生研究员和北京化工大学刘惠玉教授等人通过一锅热解方法构建了超小尺寸铁掺杂碳点(Fe-CDs,~3 nm)纳米酶。铁的掺杂和超小尺寸暴露出的大量活性位点使得Fe-CDs能够高效催化H2O2产生·OH;在近红外光激发下,Fe-CDs具有吸收光能转换为热能的特性,同时,由于光热效应提高了电子转移效率,Fe-CDs催化产生·OH的能力得到增强,从而实现光增强的抗菌治疗和伤口愈合。并且,超小尺寸的Fe-CDs 具有良好的生物相容性,有利于临床转化。此外,通过免疫组化和免疫荧光实验对促伤口愈合过程进行了深入探讨,实验结果证实其高效的愈合效果与Fe-CDs纳米酶介导的治疗方式带来的预防感染、促进成纤维细胞增殖、血管生成和胶原沉积有关。研究认为,Fe-CDs的双功能策略开辟了一条使用生物相容性无抗生素纳米材料进行伤口消毒和愈合的有效途径。相关成果以“Ultrasmall Fe-doped carbon dots nanozymes for photoenhanced antibacterial therapy and wound healing”为题发表在《Bioactive Materials》。

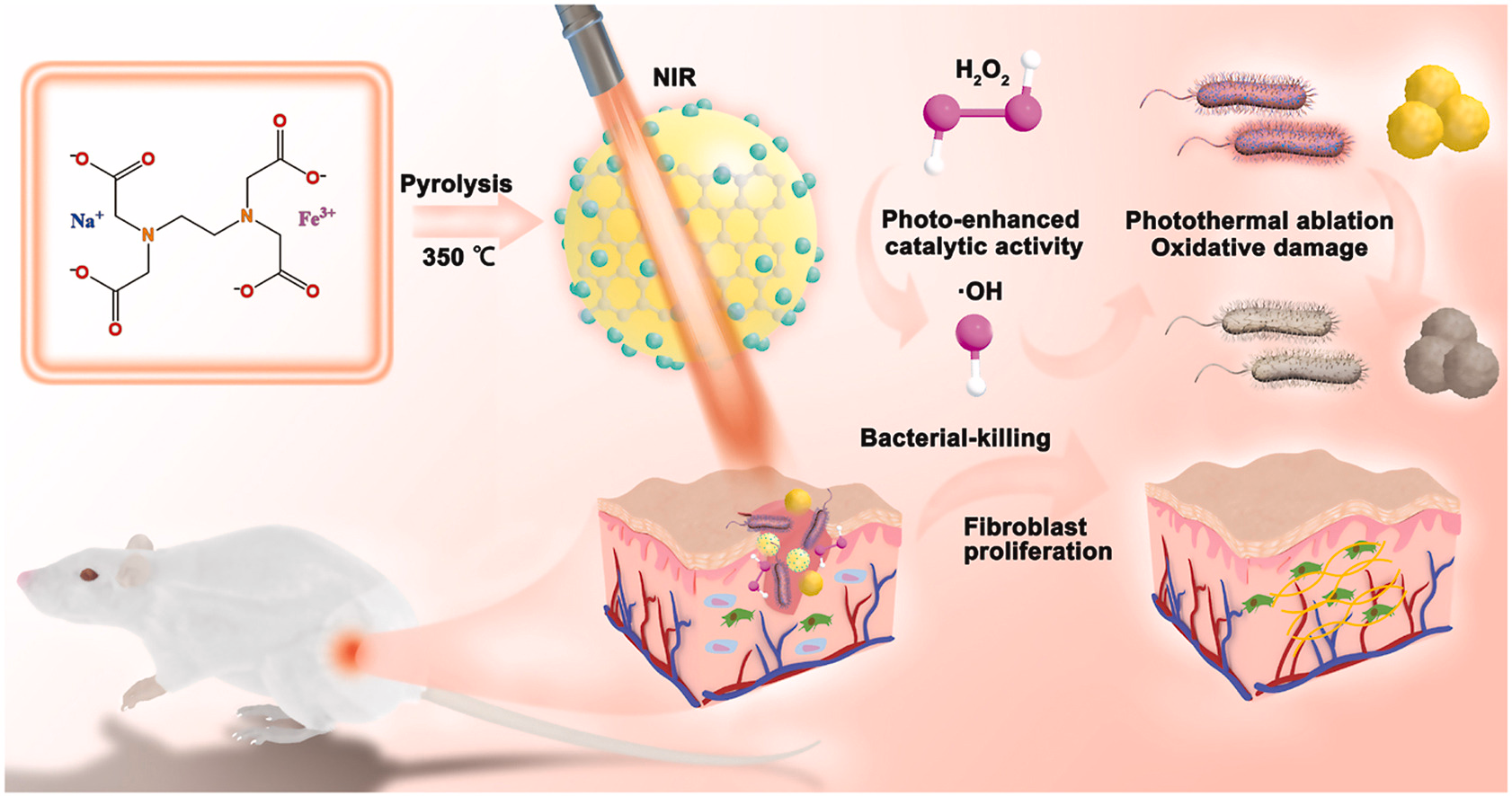
【文章要点】
通过将2g 乙二胺四乙酸单钠铁盐(NaFeEDTA)在N2气氛、350 ℃下热解2h 制备得到Fe-CDs。通过类似方法制备得到纯CDs,不同的是前驱体为乙二胺四乙酸二钠盐二水合物(Na2[H2(EDTA)]·2H2O)。EDTA具有柔性结构,是制备CDs的常用原料,EDTA与金属离子螯合后可形成饱和的类席夫碱结构。

图1. Fe-CDs的制备与表征
二、光热性能与光响应类酶活性

图2. Fe-CDs的光热及类酶活性表征
三、体外抗菌
通过平板计数法检测Fe-CDs对金黄色葡萄球菌和大肠杆菌的抑菌活性。H2O2(0.003%,1mM)在Fe-CDs的催化作用下,对大肠杆菌(约40%)和金黄色葡萄球菌(约16%)的活性有明显的抑制作用,而单独用H2O2或Fe-CDs处理的大肠杆菌和金黄色葡萄球菌的活性几乎没有下降,这些现象可以归因于·OH的产生。另外还用荧光染料SYTO-9和PI对大肠杆菌进行了活/死检测,在共聚焦激光扫描显微镜(CLSM)上显示了类似的杀菌结果。
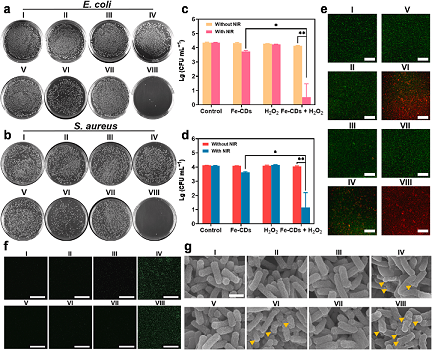
图3. Fe-CDs的体外抗菌性能评估
四、抗菌促伤口愈合
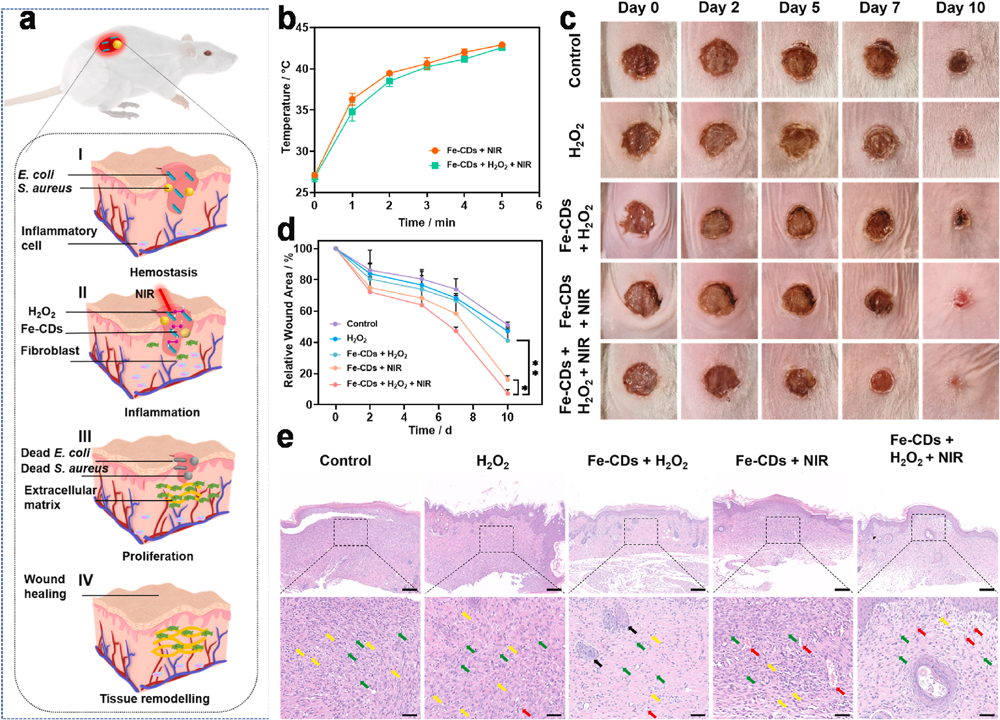
图4. Fe-CDs体内抗菌及促伤口愈合效果评估
五、机制探索
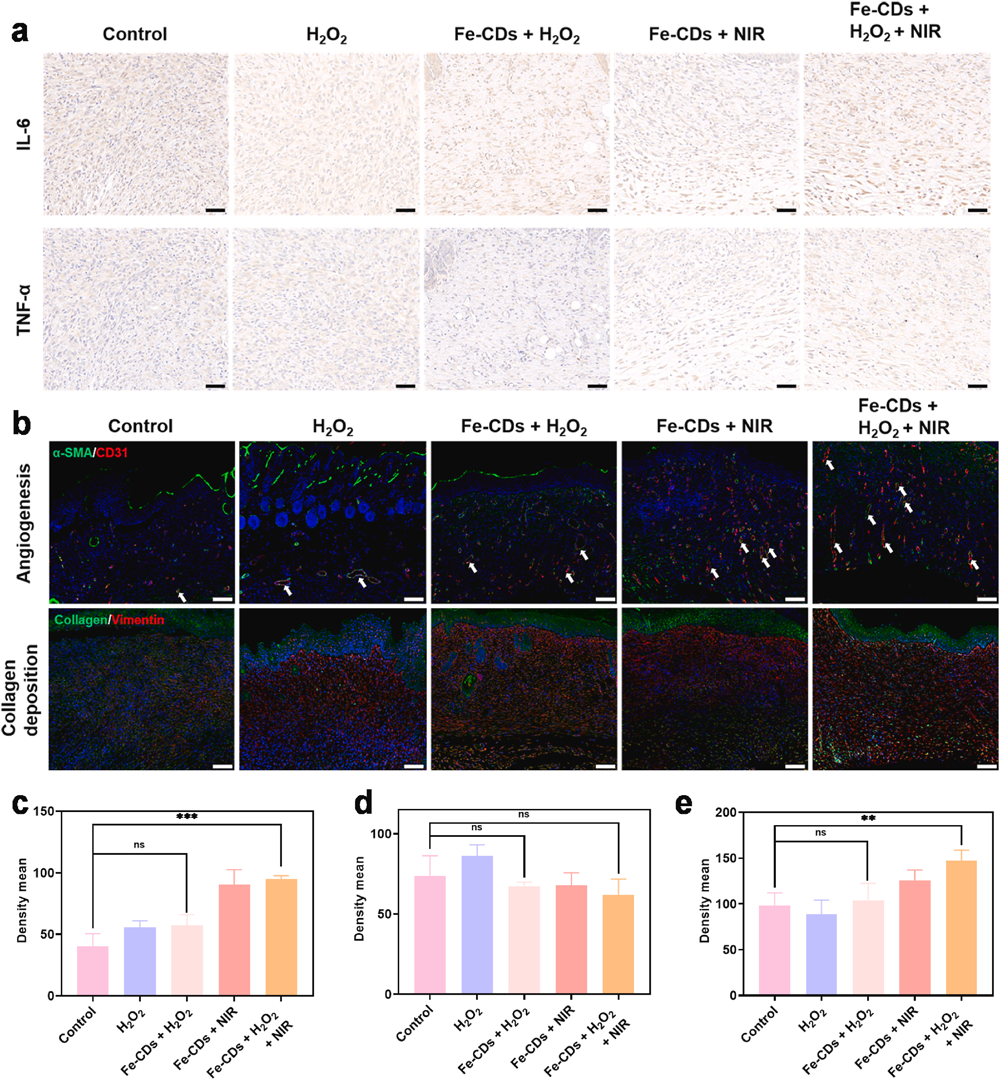
图5. Fe-CDs促伤口愈合机制研究
原文链接:
https://www.sciencedirect.com/science/article/pii/S2452199X21004886.
https://doi.org/10.1016/j.bioactmat.2021.10.023
- 杭师大黄又举教授团队 Adv. Mater.:自适应多色碳点纳米膜实现多维光学加密 2025-12-08
- 西南林大杜官本、杨龙团队 AFM:碳点桥接效应促使长链和短链聚合物交织 - 显著提高水凝胶性能 2025-12-04
- 南京邮电大学陈润锋教授课题组 Adv. Mater.:在多重刺激响应碳点长余辉领域取得新进展 2024-09-19
- 天工大高辉/余云健团队 ACS Nano:创新纳米酶精准消除肿瘤胞内菌 助力结直肠癌免疫治疗突破 2026-02-20
- 杭师大黄又举教授团队 AFM:超强H2O2亲和力的体外医疗诊断试剂盒 2025-09-08
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 青岛大学明津法团队 IJBM:兼具超疏水和光热效应的聚乳酸纤维气凝胶用于防冰除冰功能开发 2025-08-17
