脑胶质瘤(glioblastomas, GBM)是一种恶性神经系统疾病,开发诊疗新策略十分迫切。光热治疗及光声成像因其时空可控及高成像分辨率等优势,为脑肿瘤诊疗提供新思路。然而,用于脑胶质瘤诊疗的光热试剂受到脑部结构特殊性的限制:1)光照时激光需穿透颅骨及脑组织,因此需要组织穿透性更深的吸收波段,相较于近红外一区(NIR-I,600-900 nm),近红外二区(NIR-II, 1000-1700 nm)的吸收波段可以实现更深的组织渗透性以及更小的组织光毒性;2)脑部存在血脑屏障(BBB)限制光热剂(PTA)进入脑实质及肿瘤组织,降低了光热试剂的效率及成像精确性。因此,开发具有NIR-II吸收及BBB穿透性的光热试剂十分重要。

图1(a)N1小分子化学结构及N1@2P NPs制备示意图;(b)N1@2P NPs通过尺寸效应和受体介导穿透血脑屏障,实现深层原位脑胶质瘤光热诊疗示意图。

图2(a)N1@2P NPs水溶液的NIR-II吸收光谱;(b)不同浓度的N1@2P NPs在1064 nm(1 W/cm2)激光照射下的光热升温效果;(c)不同浓度的N1@2P NPs的光声信号图片;N1@2P NPs和N1@F NPs对(d) bEnd.3和(e)U251细胞暗毒性测试及对(f)U251细胞光热杀伤效果(1064 nm,0.8 W/cm2,5 min);(g)U251细胞死活染色分析。
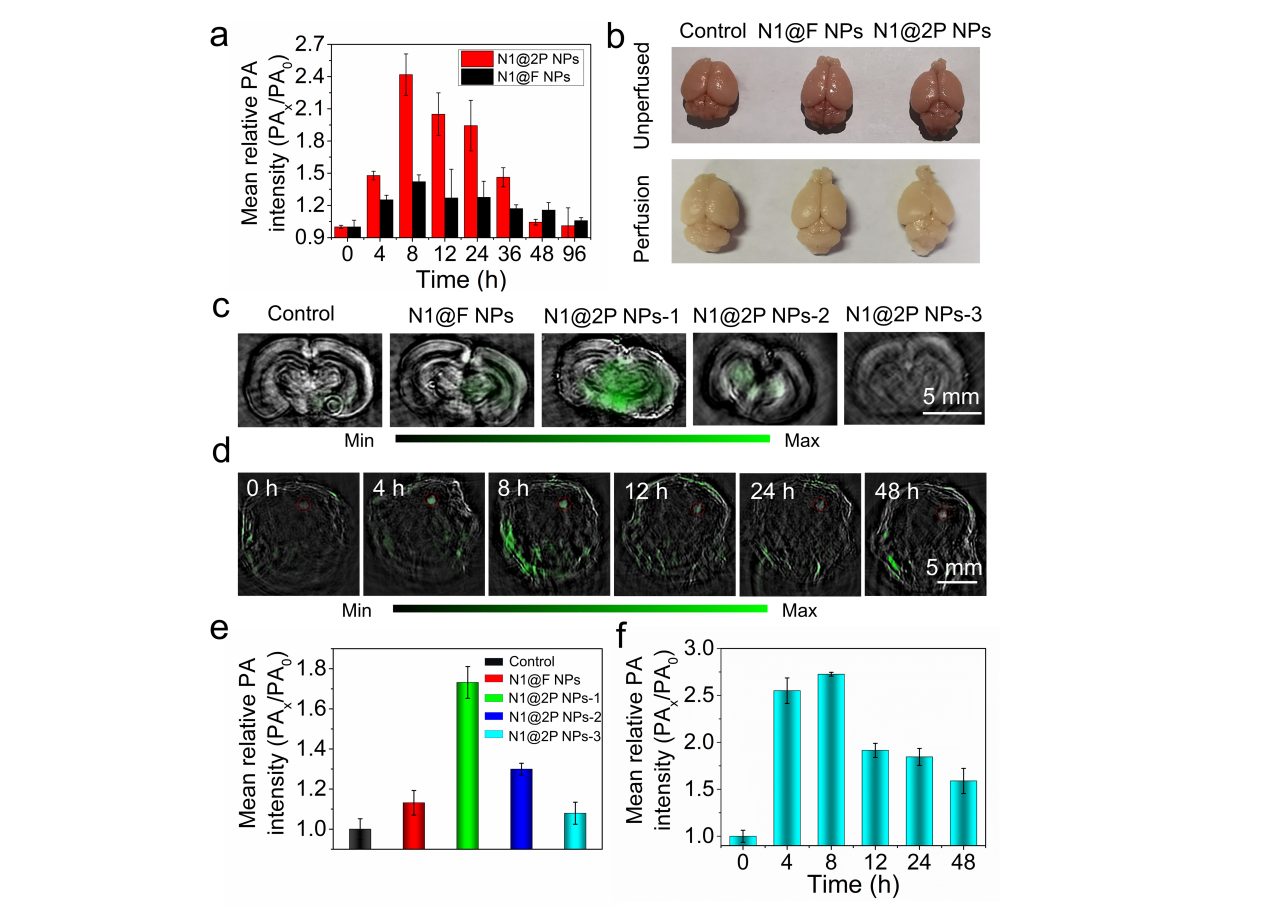
图3(a)不同组别健康小鼠脑部光声信号强度;(b)心脏灌注后小鼠脑部表观图片;(c, e)不同组别离体脑组织光声信号及强度分析,N1@2P-1 ~26 nm, N1@2P-2 ~100 nm, N1@2P-3 ~200 nm;(d, f)小鼠原位脑肿瘤组织随时间变化的光声信号图片和定量分析。

图4 (a,b)原位脑肿瘤组织光照升温曲线及红外照片;(c,d)光热治疗后原位脑肿瘤组织自发荧光监测;(e)小鼠存活时间;(f)小鼠体重变化;(g)小鼠骨髓Wright染色;(h)H&E器官染色。
综上,本研究通过引入D-A结构和延长π共轭体系的修饰策略,首次构建了苝酰亚胺基NIR-II吸收光热试剂。通过组装调控纳米粒子尺寸,并通过受体介导主动的递送策略,赋予N1高效的血脑屏障穿透性。将其应用于深层原位脑肿瘤模型,实现高分辨率的近红外二区光声成像和显着的光热治疗功效,为NIR-II光热试剂的开发提供理论依据,并为改善脑肿瘤的诊疗现状奠定基础。
该论文通讯作者为北京化工大学尹梅贞教授、秦蒙教授,第一作者为管君博士。该研究工作得到国家自然科学基金(52130309,22201156,52003021)等资助。
原文链接:https://doi.org/10.1002/smll.202300203
- 桂工甄士杰/李美静博士、广医张天富副教授、华工赵祖金教授、港中深唐本忠院士 AM:近红外二区脂质体多模态光诊疗新成果 2024-11-29
- 内蒙古大学王建国教授、姜国玉教授、港科大于涵 ACS Nano:聚合物构象扭曲策略改进聚合物亮度用于近红外二区癌症光诊疗 2024-10-08
- 武汉科技大学王晓强《Nano Lett.》:基于硼簇的“离液效应”构建细菌响应型水凝胶用于近红外二区光热治疗 2024-04-09
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
- 南开大学齐迹、孔德领/医学科学院工程所李稳 Nat. Commun.:长波长NIR-II光声成像可视化血栓协同治疗 2023-11-02
