在纳米医学领域,纳米材料已被开发和证实可以用于肿瘤免疫治疗,包括改变肿瘤微环境将“冷”肿瘤转化为“热”肿瘤,以及合理重塑免疫微环境以产生强大的免疫应答,例如,通过使用化疗、光热治疗、光动力治疗等策略诱导癌细胞产生免疫原性细胞死亡(ICD)。ICD可以增强树突细胞的抗原递呈、T细胞的激活,从而增加对实体瘤的免疫刺激和破坏免疫抑制效应。常规疗法与ICD的结合,为抗肿瘤治疗提供了新的途径和研究方向。然而,ICD触发的肿瘤微环境(TME)重塑只能提供次优的癌症免疫治疗结果,容易造成第二次的肿瘤免疫逃逸。最重要的是,尽管患者体内存在大量新抗原,但由于未能获得充分和持久的抗肿瘤免疫应答,基本上难以实现肿瘤的完全治愈。这主要是由于树突细胞(DCs)存在免疫逃逸效应,限制其有效抗原呈递能力,导致ICD效应无法从根本上影响淋巴结中的DCs和T细胞的活化。那么如何促进抗原递呈细胞(APC)的抗原递呈能力,触发原位肿瘤抗原释放,以增强免疫原性和抗肿瘤免疫响应,是开发有效纳米药物用于免疫治疗的关键。
有研究表明,DCs中的YTHDF1蛋白是实现增强肿瘤免疫治疗的潜在治疗靶点之一,YTHDF1蛋白(RNA m6A甲基化的重要读取器蛋白)涉及DCs相关的抗肿瘤免疫过程,其下调可有效增强DCs的肿瘤抗原交叉呈递能力,限制DCs的免疫逃逸效应,进一步提高细胞毒性T细胞在肿瘤部位的浸润并改善抗肿瘤免疫。因此,通过设计巧妙的纳米平台,一方面利用纳米平台实现化疗及化疗相关的ICD效应,增强免疫效应,另一方面增强DCs抗原递呈能力,打破免疫逃逸瓶颈,可实现协同的癌症免疫治疗,这无疑为扩大和加强免疫治疗提供了新思路。
在研究团队前期工作中,已经证明金刚烷(Ad)修饰的第三代(G3)聚酰胺-胺(PAMAM)树状大分子和β-环糊精(β-CD)修饰的第五代(G5)PAMAM树状大分子之间可以通过主客体识别,自组装形成G5-CD/Ad-G3核壳结构树状大分子(CSTDs)。合成的CSTDs显示出比单独G5更高的基因转染效率、药物上载率以及增强的钆配合物r1弛豫率和基于增强渗透滞留(EPR)效应的被动靶向,现已成功应用于乳腺癌细胞的基因、化疗的联合治疗和弛豫率及EPR效应双重增强的肿瘤磁共振成像(J. Mater. Chem. B 2020, 8, 2768-2774,Biomacromolecules 2021, 22, 2181-2188)。此外,壳层分子G3-Ad还可作为独立模块分别修饰吡啶、皮啡肽和RGD肽,经过主客体识别G5-CD自组装形成多功能CSTDs,乙酰化并络合铜离子合成多功能CSTD-铜络合物后,通过皮啡肽与μ-阿片受体结合跨越BBB,利用RGD靶向脑胶质瘤,运用铜离子的r1弛豫性能和发生类芬顿反应的能力,实施原位脑胶质瘤的磁共振成像和化学动力学治疗(Nano Today 2021, 41, 101325)。然而,目前还没有报道涉及使用CSTD负载药物进行化疗-免疫治疗,也没有递送功能性基因对DCs进行改造,从而改善肿瘤的免疫治疗。

图1. 基于CSTDs的双纳米模块的制备和作用示意图。
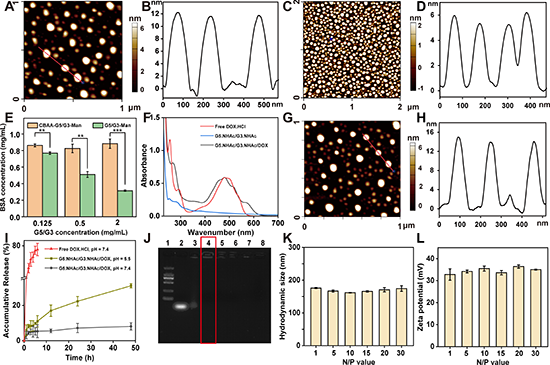
图2. CSTDs和基于CSTDs的纳米模块的表征。G5.NHAc/G3.NHAc(A,B)和CBAA-G5/G3-Man(C,D)的AFM图;(E)CBAA-G5/G3-Man的抗蛋白吸附试验图;(F)基于DOX的各材料紫外吸收曲线;(G, H)G5-G3-D复合物的AFM图;(I)不同pH条件下,G5-G3-D复合物中DOX体外释放动力学研究图;(J)不同N/P比下,CBAA-G5/G3-Man压缩YTHDF1 siRNA的琼脂糖凝胶阻滞实验图;CBAA-G5/G3-Man/YTHDF1 siRNA复合物在不同N/P比条件下的流体动力学尺寸(K)和ζ电位(L)。
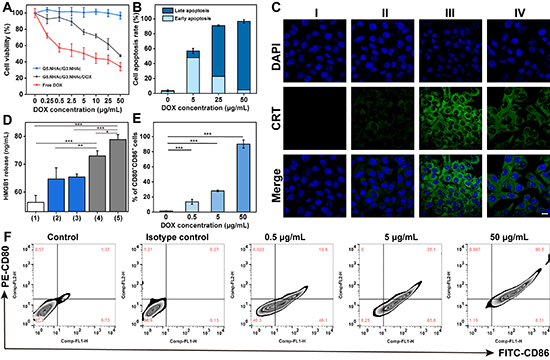
图3. G5-G3-D复合物纳米模块的体外化疗效果和ICD效应。(A)不同材料处理后的4T1细胞活力图;(B)不同浓度的G5-G3-D复合物处理后4T1细胞的凋亡情况统计图;各组材料与4T1细胞共孵育后,(C)CRT的表达,(D)HMGB-1的释放,各组材料刺激DCs熟化的流式统计图(E)和流式分析图(F)。
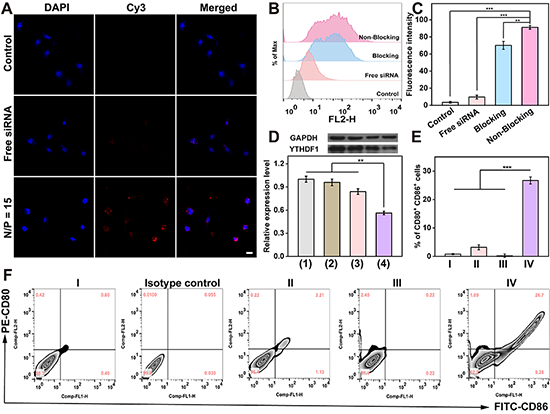
图4. CBAA-G5/G3-Man/YTHDF1 siRNA复合物纳米模块的基因转染效果和DC成熟评估。(A)不同材料处理DCs 4小时后的共聚焦显微镜图像;(B, C)不同条件(有无Man阻断)下,CBAA-G5/G3-Man/Cy3-YTHDF1siRNA复合物处理4小时后,DCs的吞噬效率;(D)基于WB测定的蛋白质表达图像和定量分析图:1-4分别代表PBS、CBAA-G5/G3-Man、游离YTHDF1 siRNA和CBAA-G5/G3-Man/YTHDF1 siRNA复合物;分别用PBS(I)、游离YTHDF1 siRNA(II)、CBAA-G5/G3-Man/ NC siRNA(III)和CBAA-G5/K3-Man/YTHDF1 siRNA(IV)处理DCs 24小时后,刺激DCs熟化的流式统计图(E)和流式分析图(F)
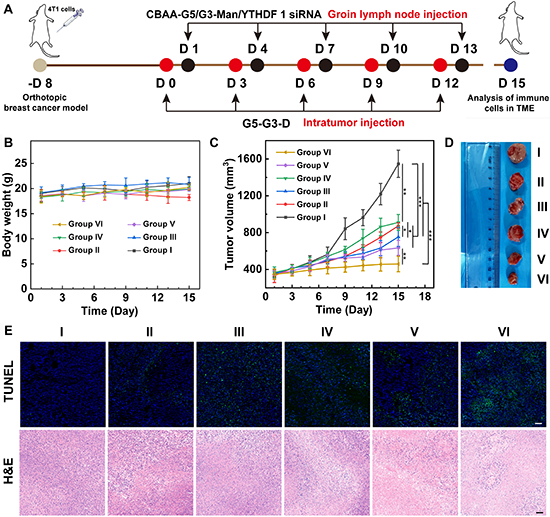
图5. 体内抗肿瘤效果。(A)两种基于CSTDs的纳米模块:G5-G3-D复合物与CBAA-G5/G3-Man/YTHDF1 siRNA复合物组合的处理方案图。治疗期间小鼠体重变化图(B)、相对肿瘤体积变化统计图(C)和代表性肿瘤图片(D)。(E)治疗15天后小鼠肿瘤部位的TUNEL和H&E染色图。对于(B-F):Ⅰ代表PBS;Ⅱ代表游离DOX;Ⅲ代表G5-G3-D;Ⅳ代表CBAA-G5/G3-Man/YTHDF1 siRNA;V代表游离DOX + CBAA-G5/G3-Man/YTHDF1 siRNA;VI代表G5-G3-D + CBAA-G5/G3-Man/YTHDF1 siRNA。
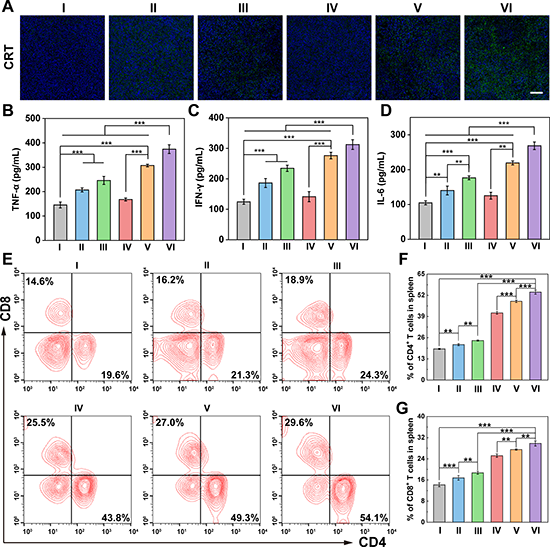
图6.体内免疫反应。不同组治疗后15天肿瘤切片中CRT的免疫荧光染色(A)和血清中细胞因子TNF-α(B)、IFN-γ(C)和IL-6(D)水平以及脾脏中CD4+和CD8+T细胞的流式细胞术测定数据(E-G)。对于(A-G):Ⅰ代表PBS;Ⅱ代表游离DOX;Ⅲ代表G5-G3-D;Ⅳ代表CBAA-G5/G3-Man/YTHDF1 siRNA;V代表游离DOX + CBAA-G5/G3-Man/YTHDF1 siRNA;VI代表G5-G3-D + CBAA-G5/G3-Man/YTHDF1 siRNA。
简而言之,该研究基于CSTDs设计的双纳米模块充分利用了CSTDs相对于单代树枝状大分子在改善药物负载、放大肿瘤穿透/EPR效应和提高基因递送效率方面的优势,具有以下特点:1)G5-G3-D复合物作为其中一个纳米模块用于肿瘤的化疗,同时用于ICD诱导使DCs成熟;2)CBAA-G5/G3-Man/YTHDF1 siRNA复合作为另一个纳米模件,通过对DCs中YTHDF1表达的基因沉默来刺激DCs成熟,增强其抗原递呈能力;3)这两大纳米模块通过对癌细胞和DCs的程序化治疗以协同增强T细胞介导的肿瘤免疫治疗,从而实现了对小鼠原位乳腺癌模型的增强型化学免疫治疗。本研究制备的CSTDs双纳米模块为协同调节T细胞以实现增强的抗肿瘤化学免疫治疗提供了新思路。
文章链接:https://doi.org/10.1016/j.jconrel.2023.05.021
- 东华大学郭睿教授/史向阳教授课题组《ACS AMI》:双响应核壳树状分子用于肿瘤细胞的基因编辑增强免疫检查点阻断治疗 2023-03-24
- 东华大学史向阳教授课题组在核壳结构树状大分子用于肿瘤增强MR成像上取得新进展 2021-04-19
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
- 香港科大唐本忠院士团队/武大王富安课题组 JACS:设计一种AIE螺环近红外发射探针用于DNAzyme敏化增强的乳腺癌光热治疗 2024-12-14
- 川大高会乐教授课题组 Nat. Commun.:MMP-2响应性-线粒体靶向的PROTAC-PDT联合疗法抑制乳腺癌及其脑转移 2024-12-03
