在靶向杀死癌细胞的同时对机体的正常组织和细胞无毒副作用,这在临床实践中仍面临巨大的挑战。不同于正常组织,肿瘤微环境(TME)表现出诸多独特的特征,包括弱酸性pH、缺氧、内源性过氧化氢(H2O2)、过量的谷胱甘肽(GSH)和免疫失衡,这可能既是肿瘤耐药的主要因素,也是目前肿瘤治疗的主要障碍。然而,从另一个角度来看,肿瘤在TME中独有的特征也可能会成为改善肿瘤治疗的一个充满前景的突破口。化学动力学治疗(CDT),作为一种高选择性和内源性激活的治疗方式,在肿瘤特异性治疗中已经展现出巨大的潜力,并且能够减少全身性毒副作用。特别是过渡金属基纳米材料在缺氧的TME下,解离的金属离子与H2O2发生芬顿(Fenton)或类芬顿(Fenton-like)反应,生成羟基自由基(×OH,一种ROS),引发细胞凋亡,从而实现癌症的CDT。然而,TME中过量的GSH(2-10 mM)和内源性H2O2不足(~100 mM)会分别通过有效消耗产生的ROS和阻碍ROS的大量生成,严重降低CDT的效果。因此,通过可控的TME调控或增强的ROS生成来提高CDT就显得至关重要,并且基于CDT的多模态协同治疗已在改善癌症治疗效果方面展现出巨大潜力。
青蒿琥酯(ART)是传统中药青蒿素的一种衍生物,含有活性基团内过氧桥键,具有良好的抗癌活性和可忽略的毒副作用。值得注意的是,ART的内过氧桥键可被Fe2+还原,生成高毒性的超氧自由基(×O2-,一种ROS),造成胞内脂质过氧化物的积累、蛋白质和DNA的损伤,诱导癌细胞凋亡。因此,通过增加细胞内ROS和避免TME中H2O2的缺乏,ART已经被用于实现高效CDT,这可以很好弥补Fenton或Fenton-like反应因TME中内源性H2O2不足而导致ROS产量受限的缺陷。然而,疏水性、不稳定性、较差的药代动力学和生物利用度限制了ART在肿瘤治疗中的临床应用。尽管多种基于ART的纳米平台已被开发用于肿瘤治疗,但仍然存在非特异性、单模态治疗疗效有限和仅由内源性Fe2+刺激生成的ROS不足等诸多问题,都极大地限制了其治疗效果和转化应用。
此外,具有肿瘤特异性靶向能力的纳米平台可以通过改善纳米药物在肿瘤部位的积累来进一步提高抗肿瘤效果。纤连蛋白(FN)作为一种具有良好生物相容性的蛋白质,其中心细胞结合域含有Arg-Gly-Asp多肽序列,可以特异性地靶向avb3整合素过表达的肿瘤细胞。然而,简单地制备具有多种成分、均一稳定的“一体化”纳米平台用于肿瘤诊疗仍然存在巨大的挑战,这也延缓了纳米医学的临床转化进程。在纳米平台的化学合成方面,微流控技术通过控制反应动力学、反应液类型、液体混合方式和反应温度等来精确控制多组分反应和纳米平台的组成、形貌和尺寸分布。并且,微流控技术已被用于制备各种用于肿瘤诊疗的基于介孔硅、超小超顺磁性氧化铁、金和脂质体的高质量纳米平台。特别是,为了高效地制备高质量纳米平台,通过调节侧面入口和中间入口的流量比来引起微漩涡,实现输入流体的快速混合,从而有效地封装所有组分,得到高质量的纳米平台。

图1. FDRF NCs的微流控制备及其T1 MR成像引导的肿瘤化学-化学动力学-免疫三模态联合治疗的示意图。
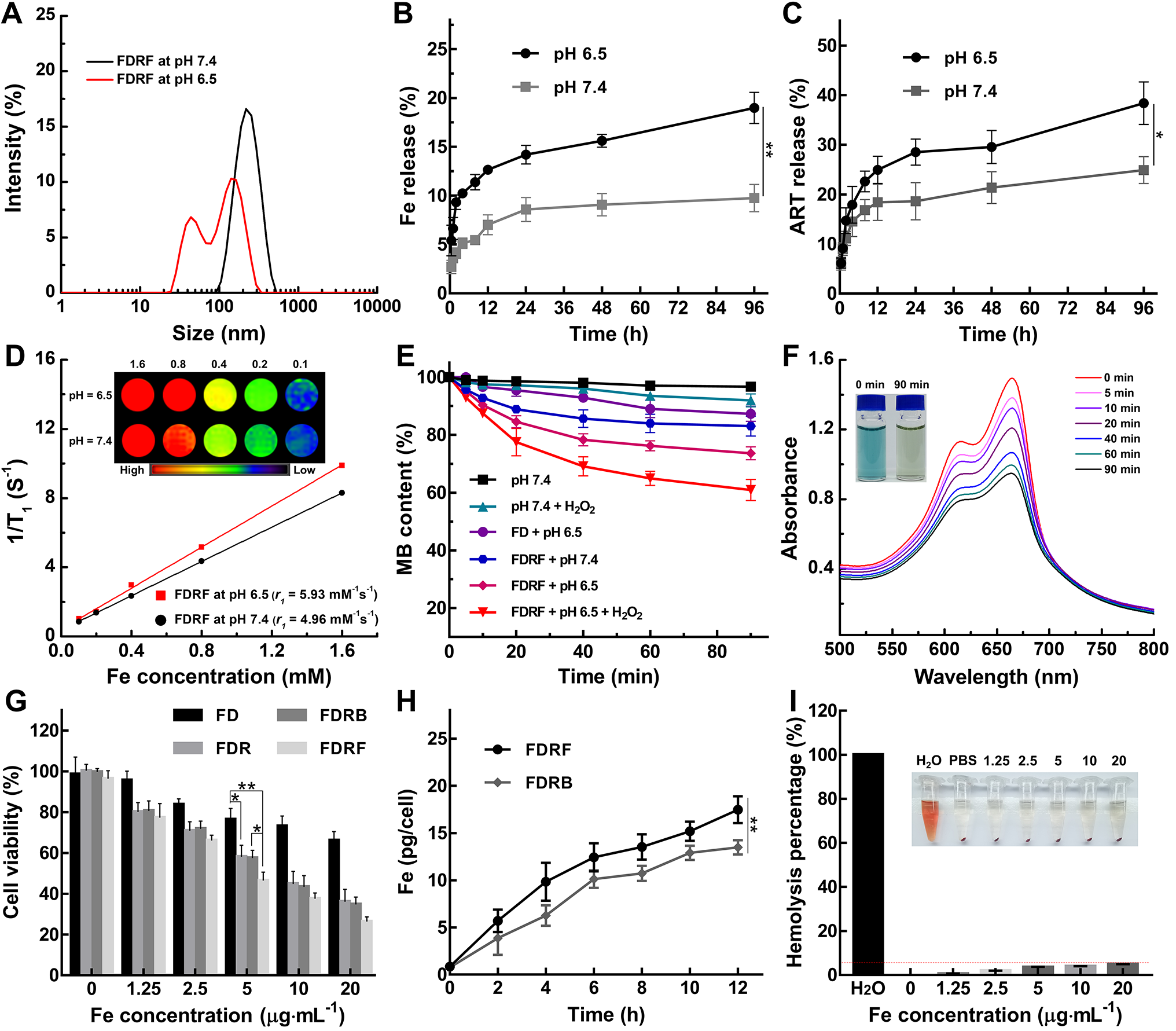
图2. FDRF NCs在不同pHs条件下的水合粒径(A)、Fe(B)和ART(C)的释放曲线、T1 MR成像以及弛豫率r1(D);MB在不同条件下随时间的降解曲线(E);MB在FDRF NCs + pH 6.5 + H2O2(10 mM)条件下随时间的降解情况(F);不同材料处理的细胞活力检测结果(G);FDRB NCs或FDRF NCs与4T1细胞共孵育不同时间后对铁的摄取情况(H);不同浓度FDRF NCs的溶血率(I)。

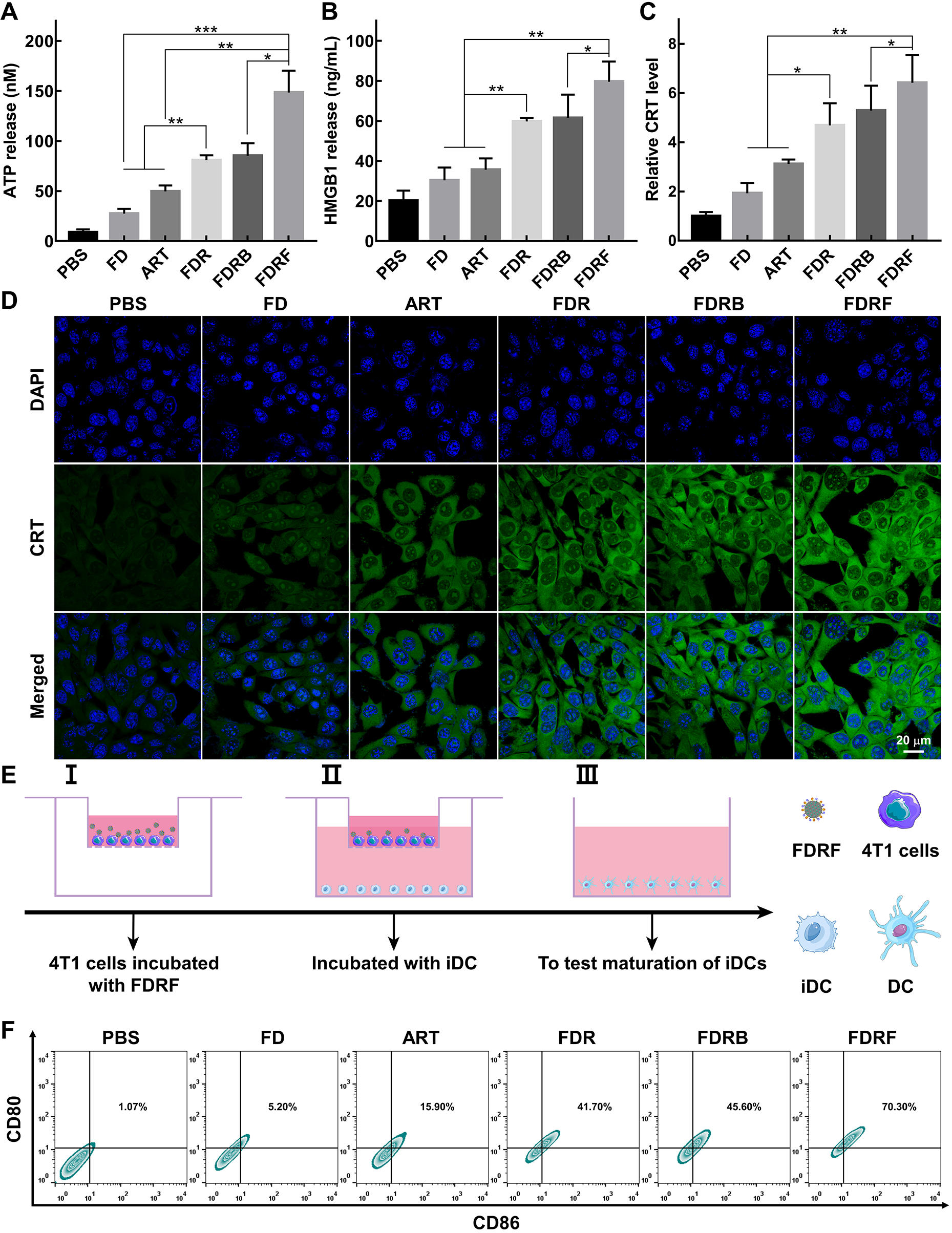
图4. 不同处理后4T1细胞释放ATP的水平(A)、HMGB1的水平(B)和4T1细胞膜表面暴露CRT的水平(C-D);FDRF NCs处理的4T1细胞与树突细胞共孵育示意图(E);不同处理后树突细胞的熟化情况(F)。

图5. 尾静脉注射不同材料后小鼠体内T1 MR成像图(A-B);FDRF NCs + A-PD-L1联合治疗的时间表(C);治疗结束后,不同组小鼠的相对肿瘤体积变化曲线(D),生存率变化曲线(E),相对体重变化曲线(F),肿瘤切片的HE、TUNEL和Ki-67染色结果(G),以及肺切片的HE染色结果(H)。

图6. 不同治疗后,小鼠肿瘤组织切片的CD4+ T细胞和CD8+ T细胞的免疫荧光染色情况(A);小鼠肿瘤部位的CD4+ T细胞和CD8+ T细胞的比例(B)、Tregs的比例(C);小鼠血清中IL-6(D)、TNF-a(E)和IFN-g(F)的细胞因子水平。
以上研究成果以“Microfluidic synthesis of fibronectin-coated polydopamine nanocomplexes for self-supplementing tumor microenvironment regulation and MR imaging-guided chemo-chemodynamic-immune therapy”为题,发表于国际著名期刊Materials Today Bio(DOI: 10.1016/j.mtbio.2023.100670)。东华大学生物与医学工程学院博士研究生杨瑞为第一作者,东华大学史向阳教授为通讯作者。该工作得到了国家重点研发计划项目、上海市科委等项目的资助。
论文链接:https://doi.org/10.1016/j.mtbio.2023.100670
- 西南大学曾建兵《Macromolecules》:聚多巴胺辅助构建高性能室温自修复导电弹性体 2025-10-19
- 新疆大学吐尔逊·阿不都热依木教授团队 CEJ: 聚多巴胺-PEDOT基便携式传感器用于氯丙嗪和诺氟沙星的同步测定 2025-09-05
- 新疆大学吐尔逊·阿不都热依木教授团队 AFM:利用3D Ti3C2Tx 混合电极材料增强电化学储能 2025-07-31
- 东华大学李静超、史向阳团队 Nano Today:近红外二区光激活型半导体聚合物纳米介质实现三合一肿瘤微环境调节用于联合免疫治疗 2023-05-14
- 南方医科大学郭金山教授Small: 按需拆卸pH响应释放铕离子的医用胶黏剂通过贯序性炎症微环境调节和促血管生成促进糖尿病创面修复 2022-11-05
- 东华大学史向阳/沈明武团队 ACS Nano:基于树状大分子的共递送体系用于MR成像引导的肿瘤化学动力学/免疫联合治疗 2023-11-28
- 东华大学史向阳教授团队 Nano Today:微流控合成肿瘤微环境调控型超小氧化铁纳米团簇用于动态MR成像导引的肿瘤联合治疗 2022-09-17
