为实现肿瘤的精准诊疗,开发肿瘤微环境(TME)刺激响应性成像诊断和药物递送的智能纳米药物至关重要。然而,由于肿瘤部位复杂的生理和病理障碍,实现纳米药物的高效肿瘤递送仍然面临着巨大挑战。因此,在开发新型智能诊疗纳米平台时,需要考虑多种障碍,主要包括免疫清除、网状内皮系统(RES)引起的滞留效应、高间质液压力、血管渗漏和淋巴引流不良等。为了克服免疫和RES器官清除,由于癌细胞膜(CCM)上存在免疫片段、抗原和膜锚蛋白,多种CCM包裹的仿生纳米平台被赋予了免疫逃逸和同源肿瘤靶向能力。为了实现精准的成像诊断、有效的肿瘤给药和降低全身毒副作用,设计TME(酸性pH、过量谷胱甘肽(GSH)等)刺激响应性释放药物的智能纳米药物尤为关键。
对于纳米药物的开发来说,传统合成方法存在诸多缺陷,在重复性制备相同理化性质和足够数量的高质量纳米平台方面显得力不从心。特别是不同批次的纳米平台差异较大,这严重阻碍了其临床转化应用。相比之下,微流控技术能够通过在微米尺度空间操控微流体进行反应,可以精确控制纳米平台的合成过程,包括成核、生长和聚集。微流控作为一种很有前途的技术,具有试剂损耗低、可控制备和一步合成等特点,在合成高质量纳米平台方面具有相当的优势,能极大助力纳米药物的临床转化。

图1. FDPC的微流控制备(A)和NFDPC的非微流控制备(B)及其用于动态T2/T1 MR成像导引的肿瘤光热-化学-化学动力学三模态联合治疗的示意图(C)。
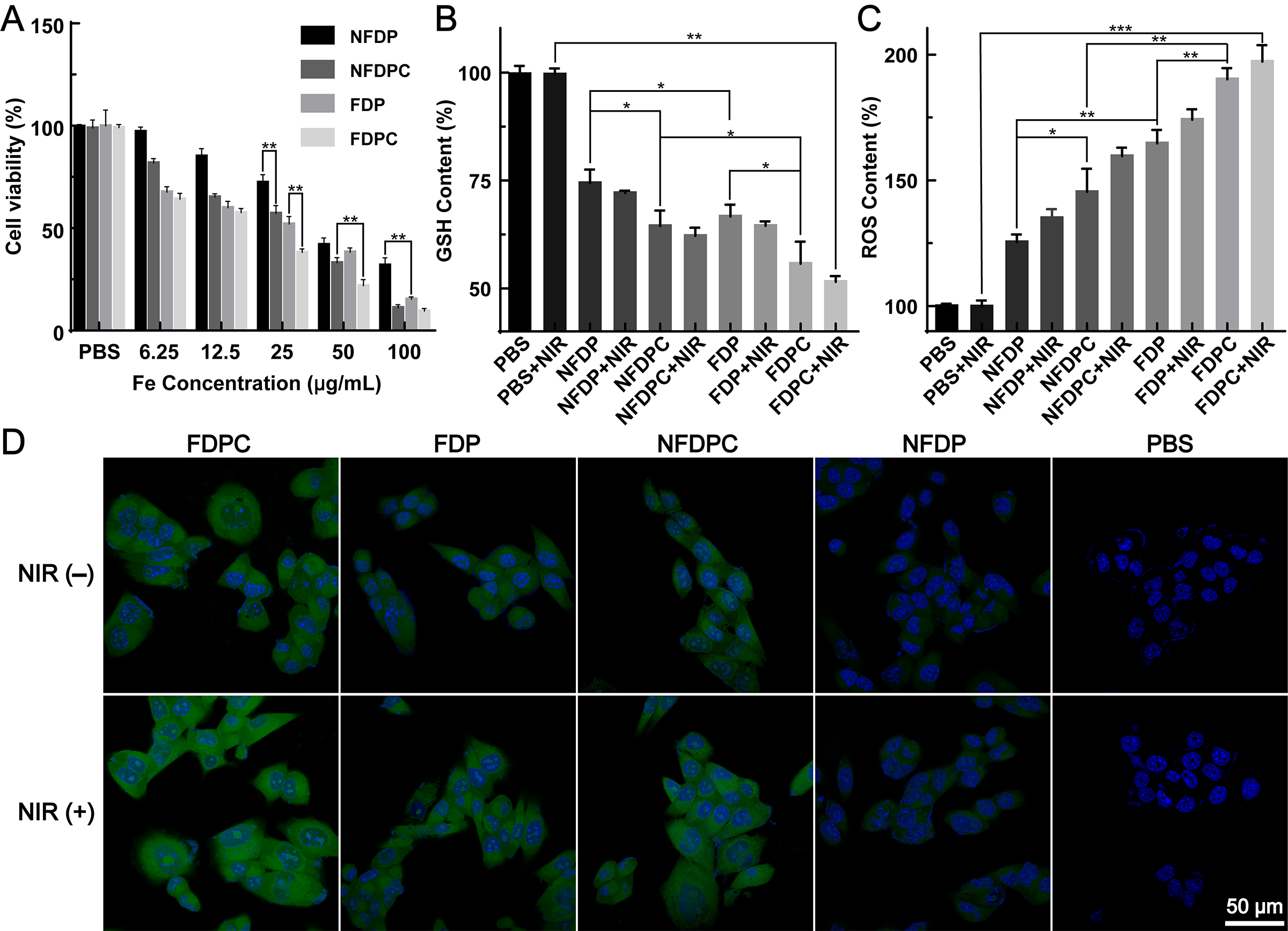
图2. 不同材料处理的细胞活力检测结果(A);不同方式处理后细胞内GSH水平变化情况(B);(C-D)不同方式处理后细胞内ROS水平变化情况。


图4. 小鼠体内治疗过程示意图(A);治疗14天内小鼠肿瘤体积及体重变化曲线(B-C);治疗第14天肿瘤照片(D);治疗第14天肿瘤切片的HE和TUNEL染色结果(E);治疗第14天主要脏器切片的HE染色结果(F)。
简言之,该研究设计的FDPC纳米平台的主要优势在于以下几个方面:1)与传统湿化学方法制备的类似物相比,基于微流控的方法制备的FDPC纳米平台具有更好的均一性、胶体稳定性和TME刺激药物释放性能;2)通过二硫键的断裂消耗GSH和基于超小铁介导的ROS生成,调控肿瘤微环境,降低癌细胞的抗氧化能力,促使癌细胞对药物和ROS敏感,减少毒副作用;3)FDPC纳米平台具有良好的同源靶向性能、光热性能和GSH响应的MR成像性能,可用于靶向肿瘤GSH响应的动态T2/T1 MR成像和联合治疗。
论文链接:https://doi.org/10.1016/j.nantod.2022.101615
- 中南大学蒋炳炎、吴旺青教授 CEJ:突破微流控芯片模内键合技术 2024-12-19
- 哈佛医学院Y. Shrike Zhang教授团队 PNAS:闭环模块化精确控氧多器官芯片系统 2024-11-15
- 北航常凌乾教授等《Biosens. Bioelectron.》:手指驱动式微流控芯片用于结核病的快速多重诊断 2021-09-27
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
- 中科院成都生物所李帮经研究员课题组:双重肿瘤微环境刺激响应性纳米递药体系研究获进展 2017-11-27
