手术切除作为治疗恶性黑色素瘤的主要策略,挽救了大量患者的生命。然而,手术不可避免地会导致皮肤和周围组织的严重损伤。而且,伤口周围的残留肿瘤细胞进一步引起肿瘤复发和转移,导致恶性黑色素瘤即使在手术后也具有较低的五年生存率。因此,除了手术治疗之外,恶性黑色素瘤仍需要额外的治疗以消除残余肿瘤,同时促进皮肤组织的再生。
肿瘤清除和组织再生分别依赖于肿瘤和正常细胞的某些生物学行为,而这些行为可能受到细胞内微环境的调控。在这些细胞中按需执行任务,从而操纵细胞微环境的纳米材料将是实现综合治疗的一种有希望的方法。在各种细胞内微环境中,铜和一氧化氮(NO)密切参与肿瘤组织和健康组织的不同生理和病理过程,有望作为操纵的理想目标。因此,设计适当的纳米材料来降低肿瘤细胞中异常高表达的铜,并在肿瘤细胞和正常细胞中按需释放相应剂量的NO,将实现肿瘤消除和组织再生一体化治疗,从而有效抑制恶性黑色素瘤进展。
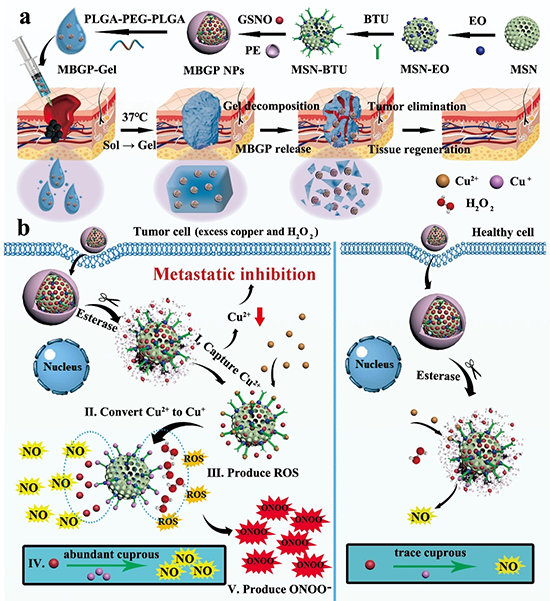
图1. MBGP凝胶的合成和一体化治疗机制示意图。

图2. MBGP-Gel的铜依赖性功能。
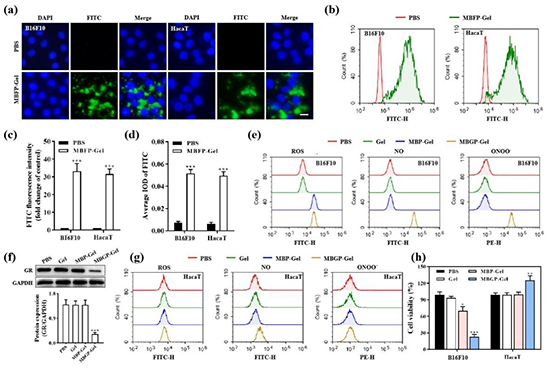
图3.MBGP-Gel在肿瘤治疗和组织再生中的体外细胞选择性
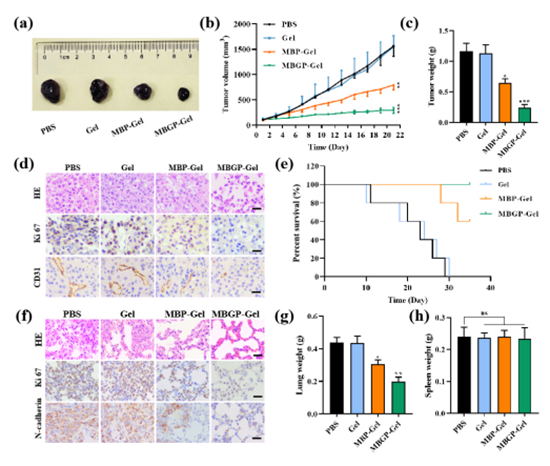
图4. MBGP-Gel的体内抗肿瘤特性

图5. 肿瘤复发抑制及皮肤再生评价。
在此工作中,作者创造性的提出了一种双向调控细胞行为的治疗机制,该综合治疗策略通过肿瘤细胞与健康细胞微环境的显著差异,既实现了ROS与NO通过亚铜催化协同治疗破坏原发肿瘤,又通过铜掠夺控制肿瘤细胞内铜的浓度,抑制肿瘤转移,更重要的是同步实现了NO促进皮肤再生的功能。这可能有助于理解和拓展智能纳米材料在肿瘤术后残余肿瘤切除和组织再生的综合治疗中的应用。
文章链接:https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.202304394
通讯作者简介
西安交通大学陈鑫教授:西安交通大学化工学院教授,国家级高层次青年人才,陕西省百人计划学者,陕西省优秀留学归国人员,英国皇家化学会2020新锐科学家,西安交通大学A类青年拔尖人才,中国生物医学工程学会组织工程与再生医学分会委员,中华口腔医学会口腔生物医学专业委员会委员,纳米肿瘤学专委会青年委员。先后主持国家自然科学基金、省部级自然科学基金等十余项。主要从事智能医用材料的研究,在Nature Biomedical Engineering, Science Translational Medicine, Science Advances, Advanced Materials, Advanced Functional Materials, ACS Nano, Biomaterials等国际知名学术期刊上发表科研论文70余篇,受邀撰写学术专著3章,申请/授权国家发明专利13项。目前担任Chinese Chemical Letters、Pharmaceutics、Nano Biomedicine and Engineering等学术期刊编委。
西安交通大学张彦民教授:西安交通大学药学院教授,陕西省天然药物研究与工程重点实验室主任、西安交通大学血管药物研究所所长等。陕西省杰出青年基金获得者、入选教育部新世纪优秀人才、陕西省中青年科技创新领军人才、西安交通大学A类青年拔尖人才等。担任中国抗癌协会抗癌药物专业委员会常务委员、中国药理学会分析药理专业委员会委员、陕西省药学会理事等。担任SCI期刊Journal of Pharmaceutical Analysis杂志常务副主编、Frontiers in Pharmacology、Frontiers in Oncology杂志副主编,Biosensors、Oncol Rep等期刊编委。主持国家自然科学基金项目、国家重大新药创制专项等30余项;发表论文200篇;申请/授权国家发明专利32项;以第一完成人获陕西省科学技术二等奖2项、获陕西高等学校科学技术一等奖1项,以参与人获国家技术发明二等奖等。
- 东南大学顾忠泽/周鑫、南京大学徐桂芳 AHM: 氢键驱动的导电热敏水凝胶用于内窥镜电外科手术 2025-06-20
- 浙江大学郑宁/谢涛团队 Adv. Sci.:具有多模态运动的液晶弹性体软体机器人 2024-03-27
- 华南理工唐本忠院士团队秦安军教授等 ACS Nano:利用氨基-炔点击反应介导的反应疗法协同光热治疗实现增强免疫治疗 2023-07-28
- 沈化大康海澜教授、华南理工王朝教授 Macromolecules:动态硫化法制备高耐油性的生物基可生物降解热塑性弹性体 2025-07-30
- 中科院纳米能源所李琳琳 AFM:筋膜枪协助可生物降解压电神经导管促进外周神经修复 2025-07-23
- 西安交大郭保林/憨勇/赵鑫团队:具有各向异性微通道和顺序递送双生长因子的可生物降解导电IPN原位冷冻凝胶用于骨骼肌再生 2024-11-24
- 华科大罗志强教授团队《Nat. Commun.》:可注射导电水凝胶实现无线、微创深部脑神经调控 2026-02-10
