近日,华中科技大学罗志强教授团队与上海交通大学医学院松江研究院王杰教授团队、美国伊利诺伊大学厄巴纳-香槟分校余存江教授团队合作,首创了一种可注射导电水凝胶(ICH),构建了基于电容耦合无线供能的深部脑刺激(DBS)系统,在帕金森病(PD)大鼠模型中实现了无需电池、微创植入、MRI兼容的有效神经调控与治疗,为下一代生物电子疗法提供了全新平台。
2026年2月4日,该研究以“Injectable hydrogel bioelectrostimulator for wireless deep brain neuromodulation”为题发表在《自然·通讯》(Nature Communications)上。
成果简介
深部脑刺激(DBS)是一种通过向大脑特定靶区植入电极进行电刺激的神经调控技术,已成为治疗帕金森病(PD)、阿尔茨海默病和癫痫等神经系统疾病的有效手段。然而,目前的DBS设备依赖于刚性电极和庞大的植入式电池,其机械性能与柔软、动态的脑组织不相容,增加了装置失效、异物反应和组织损伤的风险。有限的电池容量需要定期充电或手术更换,而用于供电的经皮导线则存在感染和机械故障的隐患。此外,磁共振成像(MRI)等神经影像技术对于阐明治疗机制至关重要,但传统的金属电极会引起严重的射频加热和图像伪影,限制了其与功能成像的整合。这些局限性凸显了对下一代DBS技术的迫切需求:它需要整合可微创植入、MRI兼容、无线供能、微型化多种特征的新型刺激器,以提升生物相容性和长期稳定性。
尽管近年来针对DBS器件侵入性和界面失配问题已出现多种改进尝试,但仍难以同时满足微创性、界面稳定性和长期安全性的需求。例如,引入柔性高分子材料虽在一定程度上缓解了力学失配问题,但相关器件仍依赖固态电极和植入式电源结构,难以摆脱手术创伤和器件互连带来的限制。导电水凝胶因其与神经组织高度相容的力学特性被认为是构建新型神经电极的理想候选,但现有体系多依赖预成型植入或高强度化学交联,在可注射成型、长期稳定性与生物安全性之间仍存在难以兼顾的矛盾。另一方面,基于磁、光或超声等外场响应的纳米材料无线能量传输策略虽然降低了器件复杂度,但普遍存在能量转换效率有限、刺激空间精度不足及长期稳定性受限等问题。
这些挑战促使作者提议开发一种可注射导电水凝胶,它能同时作为神经界面和能量转导介质,将电极和无线供能功能集成于单个软植入体中,从而简化器件架构。为实现这一概念,必须解决两个关键挑战:(1)开发合成策略以克服当前可注射导电水凝胶的局限性,包括导电性与生物相容性的权衡、机械稳定性和细胞毒性问题;(2)建立一种有效的水凝胶外场耦合机制,以利用其通过外场响应介导能量无线传输,而这是一个亟待探索的领域。在此研究工作中,作者展示了一种由原位凝胶化可注射导电水凝胶(ICH)实现的微创无线DBS新策略,该策略可在体内高频体积传导场景下,在植入的ICH周围诱导局部电场集中。ICH通过生物催化聚合和静电组装形成导电网络,展现出高导电性、类组织机械性能和高生物相容性,确保在电极-组织界面实现长期稳定的电传输。当通过电容无线功率传输将高频体积传导施加至脑组织时,ICH与周围组织之间的阻抗差异会引发伴随电荷积累的界面极化,从而导致局部电场集中,实现有效的神经刺激。
(1)材料创新:构建基于生物催化聚合与静电组装的可注射导电水凝胶(ICH)。将微量的吡咯单体、PEDOT:PSS以及葡萄糖氧化酶-过氧化物酶注入脑组织,利用内源性葡萄糖触发吡咯的生物催化聚合,同时通过带负电的PEDOT:PSS与带正电的聚吡咯之间的静电自组装,在生理条件下原位形成高生物相容性的三维导电网络。
(2)器件创新:设计基于电容耦合与界面极化机制的无线深部脑刺激系统。通过在头皮表面放置绝缘金属片作为发射电极,利用电容耦合原理将高频电场传导至脑组织。植入的ICH与周围脑组织之间存在显著的阻抗失配,在高频电场下引发麦克斯韦-瓦格纳界面极化效应,导致电荷在ICH-脑组织界面聚集,从而局部增强电场和电流密度,实现无需物理导线连接的精准、可编程电刺激。
(3)应用创新:在帕金森病大鼠模型中实现安全有效的无线DBS治疗,并借助MRI兼容性系统阐明其神经保护与环路重塑机制。在6-羟基多巴胺诱导的帕金森病大鼠模型中,将ICH注射至丘脑底核(STN)并施加无线刺激。慢性治疗显著改善了大鼠的运动行为,保护了黑质致密部的多巴胺能神经元,并增强了脑源性神经营养因子表达。得益于水凝胶材料优异的MRI兼容性,该研究首次在无线DBS治疗过程中,实现了无伪影、高分辨率的功能磁共振成像(fMRI)。
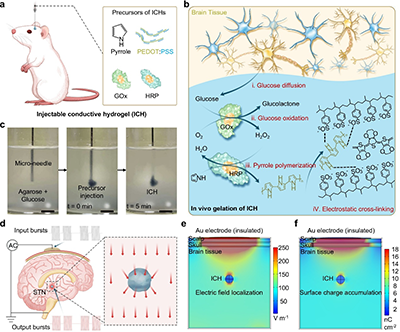
图1. 具有生物电刺激功能的可注射导电水凝胶实现无线深部脑刺激
a. ICH在脑组织内由葡萄糖引发凝胶化的制备过程示意图。
b. ICH的生物催化聚合与静电组装机制示意图。
c. ICH在模拟组织的琼脂糖凝胶中随时间的原位凝胶化代表性图像。
d. 可穿戴电容耦合系统通过电容无线功率传输在脑组织中诱发微弱容积传导。
e. 结合组织特异性介电特性的头皮-颅骨-大脑多层结构电场强度分布的有限元模拟。
f. 多层头部模型表面电荷分布的有限元模拟。
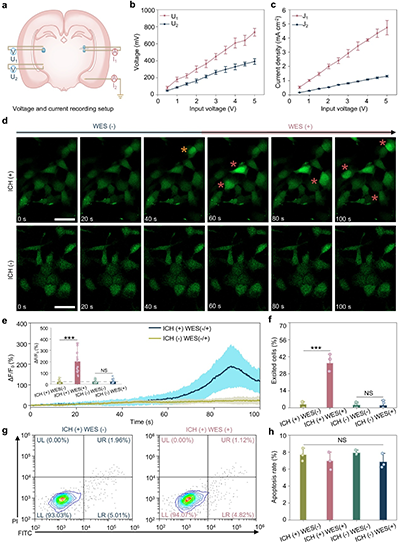
图2. 可注射导电水凝胶介导的体外无线神经刺激
a. 局部电势和电流密度测量示意图。
b. 输出电压(U1, U2)随输入电压成比例增加。
c. 电流密度(J1, J2)随输入电压成比例增加。
d. 不同条件下SH-SY5Y细胞的延时钙成像。
e. 归一化荧光变化(ΔF/F0)。
f. 被激发细胞的定量。
g. 有/无WES时PC12细胞活力的流式细胞分析。
h. PC12细胞的凋亡率。
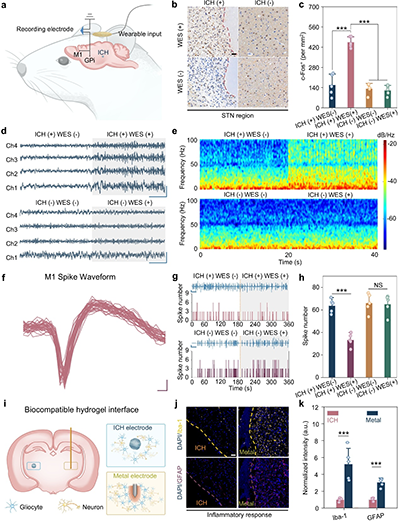
图3. 可注射导电水凝胶介导的大鼠无线DBS
a. 无线DBS实验设置示意图。
b. 大鼠STN区域细胞c-Fos表达的代表性图像。
c. STN区域c-Fos强度的定量。
d. 无线DBS期间GPi区域的电生理记录。
e. GPi区域神经活动的功率谱分析。
f. M1区域的代表性电生理波形。
g. M1区域的电生理记录。
h. 无线DBS期间的锋电位数量分析。
i. ICH与脑组织形成生物相容且无缝界面的示意图。
j. 植入ICH和金属电极的脑切片中GFAP和Iba-1的代表性免疫染色图像。
k. 植入物周围脑组织中GFAP和Iba-1的归一化荧光强度。
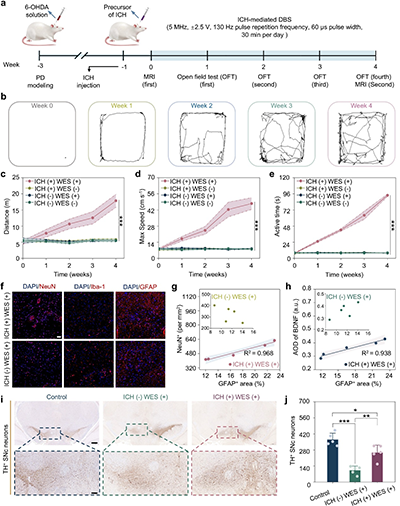
图4. 可注射导电水凝胶介导的无线DBS缓解PD大鼠的帕金森症状
a. 体内帕金森病大鼠实验时间线。
b. 旷场测试运动轨迹。
c. 总运动距离。
d. 最大速度。
e. 活跃时间。
f. NeuN、Iba-1和GFAP的代表性免疫染色。。
g. ICH(+) WES (+)组中GFAP阳性面积与NeuN阳性细胞密度的相关性分析。
h. ICH(+) WES (+)组中GFAP阳性面积与脑源性神经营养因子(BDNF)的相关性分析。
i. 酪氨酸羟化酶阳性(TH+)神经元的代表性免疫组化图像。
j. TH阳性神经元的定量。
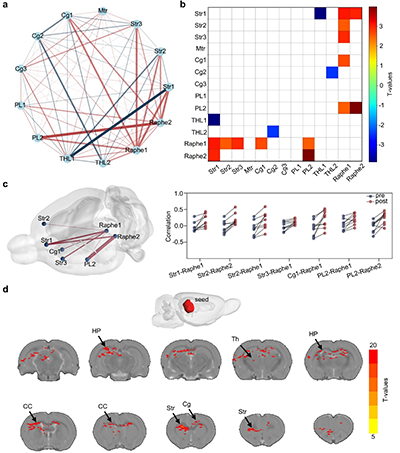
图5. 可注射导电水凝胶介导的无线DBS调节大脑功能连接
a. 连接网络分析。Str:纹状体;Mtr:运动皮层;Cg:扣带皮层;PL:前边缘皮层;THL:丘脑;Raphe:中缝核。
b. 脑区间连接强度T值的热图。
c. 治疗前后3D脑网络模型。
d. 基于中缝核种子的连接分析。Th:丘脑;CC:胼胝体;HP:海马体。
研究总结
本研究成功开发了一种兼具高导电性、组织级柔软度、优异生物相容性与可注射性的多功能水凝胶,并利用其在体电场耦合机制,构建了一套创新的无线、微创深部脑刺激系统。该系统巧妙地利用电容耦合无线供能与体积电导界面极化效应,实现了对深部脑区的精准、无电池电刺激。在帕金森病动物模型中,该疗法展现出显著的运动功能改善、多巴胺能神经保护及全脑网络重塑效果。本研究充分利用了水凝胶材料的MRI兼容性优势,首次在无线DBS治疗背景下,实现了对治疗诱导的脑功能与结构变化的无创、在体、系统级成像分析,为阐明其治疗机制提供了强有力的证据。该工作不仅为帕金森病的治疗提供了一种极具前景的全新策略,其“可注射材料-无线刺激-在体调控-多模态成像验证”一体化的研究范式,也为未来治疗癫痫、中风、抑郁症等多种神经系统疾病的下一代生物电子疗法奠定了坚实的技术与理论基础。
原文链接:https://doi.org/10.1038/s41467-026-69226-1
下载:论文原文。
- 陕科大王学川/党旭岗、温州医科大郑漫辉 AFM:可注射自修复生物质基水凝胶生物粘合剂用于伤口愈合和可穿戴生物电子一体化 2026-01-30
- 四川大学王云兵/张婕妤团队 Adv. Mater.:可注射导电水凝胶贴片通过时空调控实现心肌修复 2025-10-27
- 中南民族大学秦四勇、黄蓉团队 AFM:具有分层结构的可注射肽液晶水凝胶指导成肌细胞排列 - 促进肌肉功能恢复 2025-07-09
- 大连工业大学郭静/张森教授团队 Macromolecules:多重相互作用形成的有序纳米结构用于增韧超拉伸导电水凝胶 2025-11-10
- 中山大学付俊/南京林业大学韩景泉 AFM:基于Hofmeister效应的各向异性、抗溶胀导电水凝胶用于水下监测 2025-11-07
- 济南大学王鹏/复旦大学李卓/浙理工孟垂舟/河工大张争艳 AFM:具备水响应收缩性、可修复性与生物相容性的透明导电水凝胶 2025-10-29
- 江南大学张丹/司鹏翔、南科大程庆沙、南方医大黄国志/邹积华、滑铁卢大学赵博欣 CEJ: 无电池天线贴片无线传感人体关节转动度 2025-04-29
