骨组织缺损的修复一直是再生医学领域的重要挑战。近年来,骨髓间充质干细胞来源外泌体(BMSC-Exo)因其低免疫原性和良好的生物活性,被认为是极具潜力的无细胞治疗策略。然而,产量不足、生物功能有限以及体内递送效率低,长期制约着外泌体疗法的临床转化。
针对上述瓶颈,北京化工大学蔡晴、喻盈捷团队发表最新研究成果,构建了一种具有三重生物粘附能力的多孔微球(Bioadhesive microcryogels, BM),实现外泌体高效生产、功能增强与精准递送的一体化策略,为血管化骨再生提供了新的解决方案(图1)。
相关工作以“ Bioadhesive Microcryogels Synergize with Therapeutic Ions to Enhance BMSC-Exosomes Function for Vascularized Bone Regeneration”为题发表在《Advanced Functional Materials》上。
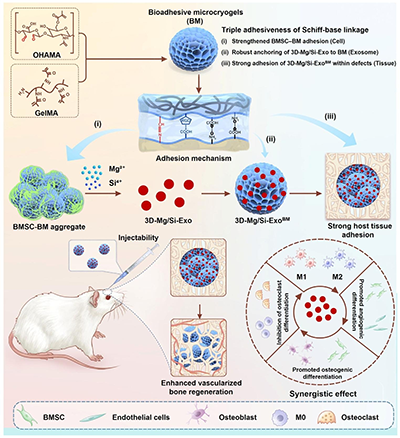
图1. 三重生物粘附微球的设计与制备。
传统3D细胞培养方式,如悬滴法或微孔板培养,虽然能够形成细胞团,但普遍存在营养交换受限、细胞凋亡增加等问题;同时,大多数外泌体载体与组织结合能力弱,容易在体内扩散流失,降低治疗效率。为解决这些难题,研究团队设计了一种由甲基丙烯酰化明胶(GelMA)与氧化透明质酸甲基丙烯酸酯(OHAMA)组成的多孔凝胶微球。OHAMA上的醛基可与蛋白上丰富的氨基形成动态席夫碱键,使微球具备独特的三重生物粘附能力:
1)粘细胞——提高外泌体产量与质量
BM与BMSC共培养后,可通过可逆共价键稳定细胞聚集体结构,显著提升细胞活性和外泌体分泌效率。同时,引入镁(Mg)与硅(Si)两种治疗性离子,对外泌体进行工程化处理,获得具有更强促血管生成与成骨能力的3D-Mg/Si-Exo。
2)粘外泌体——实现外泌体持续释放
外泌体表面蛋白中的氨基可被BM捕获固定,形成3D-Mg/Si-ExoBM,实现由爆发式释放向持续缓控释放的转变,提高外泌体的体内有效治疗浓度。
3)粘组织——增强体内定植能力
在大鼠颅骨缺损模型中,3D-Mg/Si-ExoBM可与缺损组织中的氨基发生反应,实现原位牢固粘附,减少支架材料在体内被清除,显著提升骨再生效果。
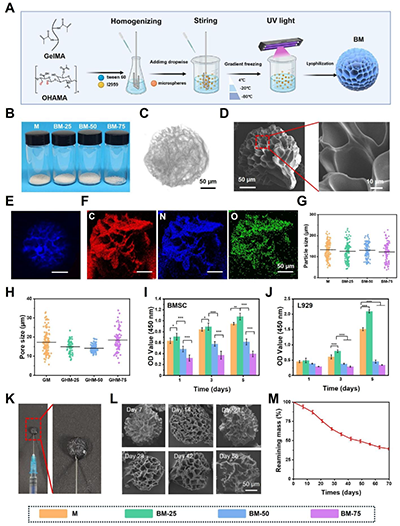
图2. 三重生物粘附性微球的理化性能表征。
综上,这种独特的三重生物粘附设计,使微球同时承担三种角色:1)3D培养基底:提升外泌体生产效率;2)功能工程化平台:赋予外泌体更强生物活性;3)递送支架:实现精准原位治疗。由于BM材料均由简单的天然高分子组成,该策略具有优异的转化前景,有望进一步拓展至软骨修复、免疫调控以及其他组织再生领域,展现出广阔的生物医学推广价值。
该工作是团队近期关于金属元素递送高分子材料的最新研究进展。金属离子在调控细胞增殖、分化及组织重建中具有关键作用,但其精准递送与可控释放仍面临挑战。围绕这一科学问题,团队基于高分子设计与制备策略,系统构建多维度可降解材料平台,实现了金属元素的缓控释放(Nature Communications 2024, 15, 9405; Advanced Materials 2024, 36, 2404971)、空间分布调控(Advanced Materials 2023,35 , 2209565;Advanced Functional Materials 2023, 33, 2304829)以及外场时空调控(Matter 2025, 8, 102366; Advanced Functional Materials, 2025, 35, 2425565),推动金属元素在生物医学中的精准应用,最大其体内治疗效益。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/adfm.202523026
- 华东理工刘润辉教授课题组 AFM:基于仿生有机-无机互穿网络的增强型微球用于骨修复 2025-11-04
- 西南科大常冠军、康明等 AFM:高能量阳离子-π(Li+-π)相互作用驱动微球滚动构建强韧复合材料的新机制 2025-09-23
- 浙江大学周民团队《Cell》子刊:“药食同源”微藻-黄芪多糖系统减少免疫治疗不良事件并增强疗效 2025-08-26
- 川大李乙文/杨振团队 Adv. Mater.:从黑色素到木质素-基于多酚-金属离子配位效应制备生物质可持续界面蒸发器用于废水处理 2025-08-28
- 重医大毛翔团队、哈工大贺良灿团队 Small 综述:复合水凝胶的创新与应用-从聚合物体系到掺金属离子和功能性纳米材料增强型结构 2025-07-04
- 希腊FORTH研究所E. Filippidi、李本科 Macromolecules:流变学研究金属离子配位双网络弹性体 2024-09-20
- 华科大牛冉/陈振兵/杨小凡 Adv. Sci.:糖工程化外泌体杂化纳米机器人增强细胞和组织渗透促进糖尿病伤口修复 2024-12-01
