近日,由加州理工学院高伟教授课题组与南加州大学、加州大学洛杉矶分校等多所顶尖科研机构合作在《Science》上发表了名为“Imaging-guided deep tissue in vivo sound printing”的研究性文章。加州理工博士后Elham Davoodi为第一作者。

这项工作带来了一个极具突破性的新方案:基于声波驱动的活体深部精准3D打印技术,简称 DISP(Deep tissue in vivo sound printing)。研究团队开发出一种以聚焦超声(FUS)为驱动源、结合温敏脂质体(LTSLs)和气泡囊泡(GVs)成像的多功能平台,使科学家们首次能够用声波当作“笔”,直接在活体深处精准“作画”,打印出导电、药物负载、细胞包埋和组织粘附等多样化功能的水凝胶结构。这项技术不仅在小鼠膀胱肿瘤模型、兔子腿部肌肉等复杂生理环境中完成了成功验证,还在体内展现出优良的生物相容性,为微创医疗、个性化治疗、再生医学等方向开辟了新路径。
DISP 平台的技术核心是一个高度巧妙的组合。研究人员设计了特殊的生物油墨(US-ink),由交联剂封装在低温敏脂质体中,常温下稳定存在,不会与周围组织或材料发生提前反应。而当聚焦超声波对准目标区域后,局部温度会被精确提升到约41–43摄氏度,诱发脂质体的相变并释放出交联剂,使油墨在指定位置迅速完成凝胶化。这种按需触发、局部精准的交联方式不仅避免了传统预混合油墨存在的毒性和反应稳定性问题,还能兼容离子型、自由基型、氧化型等多种交联机制。更重要的是,DISP 系统整合了气泡囊泡作为超声成像的对比剂,使研究人员能在实时成像引导下精准定位油墨、监测打印进程、确认交联效果,大幅提高了操作的可控性与可靠性。
这项技术究竟能打印出什么?研究团队展示了令人惊叹的多样化成果。利用导电水凝胶,他们成功在体内打印出结合碳纳米管、银纳米线等添加剂的电路结构,不仅具备良好的电信号传导能力,还能在拉伸、弯折等机械变形下保持导电稳定性,为心电图(ECG)、肌电图(EMG)、体温监测等植入式传感器提供了全新方案。而通过在水凝胶中嵌入小分子药物、蛋白质或核酸,DISP 可直接在肿瘤或病灶区域打印药物储库,实现精准定位、持续释放、减少全身副作用。此外,他们还在体内成功打印了包埋活细胞的水凝胶,用于模拟组织再生和修复场景,显示出为深部组织工程、干细胞疗法提供支持的潜力。更令人期待的是,团队开发了具有强大粘附能力的生物水凝胶,能够在受损组织表面直接打印形成高强度的封闭界面,应用于止血、伤口封闭、器官接口密封等,未来或许能为手术急救和微创修复提供新的工具。
在动物实验中,研究人员把 DISP 技术应用于小鼠膀胱肿瘤模型和兔子腿部肌肉,充分验证了其可行性和精确性。操作过程中,生物油墨通过注射或导管输送到体内指定部位,而聚焦超声在实时成像引导下精确扫描、局部激发交联剂释放,在不引发周围组织损伤的条件下,完成复杂形状、结构的打印。组织学分析(如HE染色、免疫荧光标记)表明,无论是油墨本身还是打印成型后的水凝胶,都表现出优异的生物相容性,不引发明显炎症、免疫浸润或组织坏死,材料在体内的降解、稳定性表现也符合医疗需求。特别值得一提的是,该研究还展示了结合 GV Ca2? 传感器的新颖成像方案,可以在体内实时追踪交联过程与材料空间分布,提高了操作的可见性和安全性。
展望未来,DISP 技术有潜力重塑多种医疗应用场景。对于肿瘤精准治疗,它可以直接把药物材料打印到病灶周围,减少全身性药物暴露;对于组织修复与再生,它可以像“补墙”一样在受损区域直接构建修复支架或细胞载体;对于体内可穿戴电子学,它可能实现无创植入传感器、导线、电极,建立新一代体内-体外交互系统。这不仅是3D打印技术的突破,更是精准医疗走向真正个性化、无创化的重要一步。当然,DISP 也面临诸多挑战,例如如何适应复杂动态器官(如心脏、肺部)的运动、如何优化超声参数与系统响应、如何跨越从动物实验到人体临床的巨大转化门槛等,这些都需要跨学科的深入探索与协作。
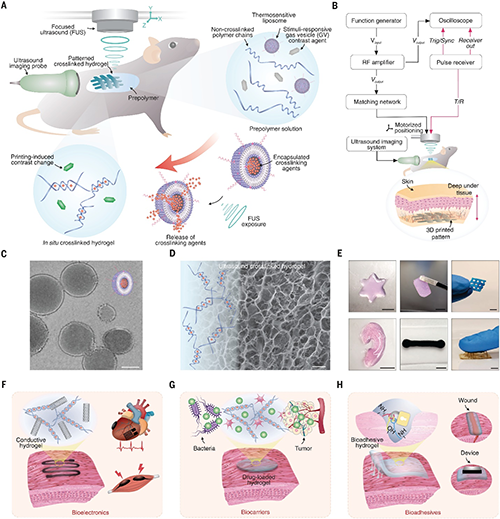
图1. 基于成像引导的活体深部声波打印(DISP)示意图。通过聚焦超声(FUS)驱动和气泡囊泡(GVs)实时成像,结合温敏脂质体(LTSLs)封装的交联剂,实现在活体组织深部按需释放并交联生物油墨,构建导电、药物负载、细胞包埋等多功能水凝胶结构,为精准治疗和再生医学提供无创、精准的在体制造方案。
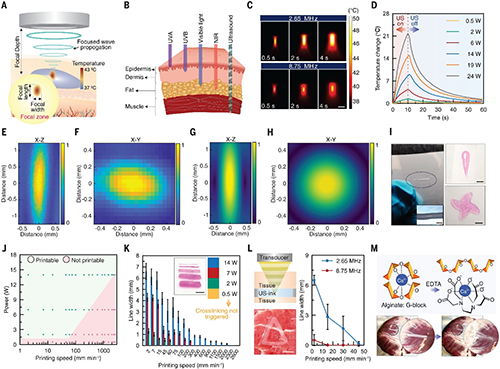
图2. 研究展示了聚焦超声(FUS)驱动的三维打印特性。超声波能精准穿透组织,将生物油墨准确定位到深部,比传统的紫外光、近红外等光源具有更强的穿透力。热模拟结果显示,在不同频率和照射时间下,聚焦区域的温度分布高度可控,而压力分布实验与模拟也证实了超声聚焦的精准性。研究团队利用这一系统打印出精细的水凝胶图案,在不同功率和打印速度下,海藻酸盐油墨表现出良好的打印分辨率,甚至能穿透 15 毫米厚的猪肉组织完成深部打印。此外,这些打印出的水凝胶图案还能通过简单的化学处理快速解离,为体内可逆材料制造提供了新途径。
总体而言,这项来自加州理工学院、南加州大学、UCLA 等顶尖科研团队的工作,展示了用声波“作笔”、在活体内精准制造生物材料的巨大潜力。未来,随着这项技术的不断优化和拓展,它或许将成为微创医疗、再生医学、体内电子学等领域的核心工具,推动生物医学进入一个全新的范式时代。对于追求更安全、更高效、更精准医疗方案的人类社会来说,这无疑是一场革命性的进步。
原文链接:https://www.science.org/doi/10.1126/science.adt0293
- 苏大陈倩教授团队《Mater. Today》:超声触发原位自组装药物水凝胶 - 为肝动脉灌注化疗带来新范式 2025-12-20
- 黄维团队杨震课题组 ACS Nano:超声“开关”调控水凝胶 - 实现糖尿病伤口的逆境重塑 2025-10-17
- 西安交大郭保林教授、憨勇教授、赵鑫副教授团队 NSR:在耐药细菌感染的运动部位创面全过程管理上取得新进展 2025-06-12
- 港中文(深圳)唐本忠院士、深圳大学王东教授等 Nat. Protoc.: NIR-II激发AIE仿生纳米用于肺结核活体光学诊疗 2025-04-18
- 中山大学贾昭君课题组 AHM: “装甲”活体益生菌平台 - 糖尿病感染伤口愈合的创新解决方案 2025-01-25
- 上海交大刘尽尧团队 Adv. Sci.:细菌活体探针的制备及成像与诊断应用 2023-12-05
- 华科大黄永安教授团队《Sci. Adv.》:仿生制造重要突破 - “界面激光剥离”精准复刻蜻蜓翅膀 2025-12-17
