抗癌药物大多数是亲脂性大分子,其水溶性差限制了药效的发挥,同时,裸药的高毒性也促使药物载体的研究备受关注。目前,许多药物载体系统,如脂质体、聚合胶束、微球和纳米颗粒等,已经成为生物医学应用中的常见类型。虽然上述载体在微纳米尺度各具特色,但如何赋予载体高效载药功能及智能响应行为依然是科学家研究的热点。
针对疏水性抗癌药物的递送问题,北京化工大学生命科学与技术学院、生物医用材料北京实验室王兴教授课题组提出了一种新策略:借助油水乳液界面发生席夫碱键合反应,利用疏水性小分子4-醛基苯甲酸龙脑酯(BF)固定亲水性大分子乙二醇壳聚糖(GC),从而制备表面带正电荷并具有亲脂性空腔的壳聚糖空心微球CHM载体(图1)。由于壳聚糖高分子链的柔性,以及疏水小分子的分散性,使得形成的CHM类近于柔性囊泡,具有独特的形态可适性,这与传统的大多数药物载体不可适形性截然不同。因此,CHM是一种新型的形态可适性药物载体。
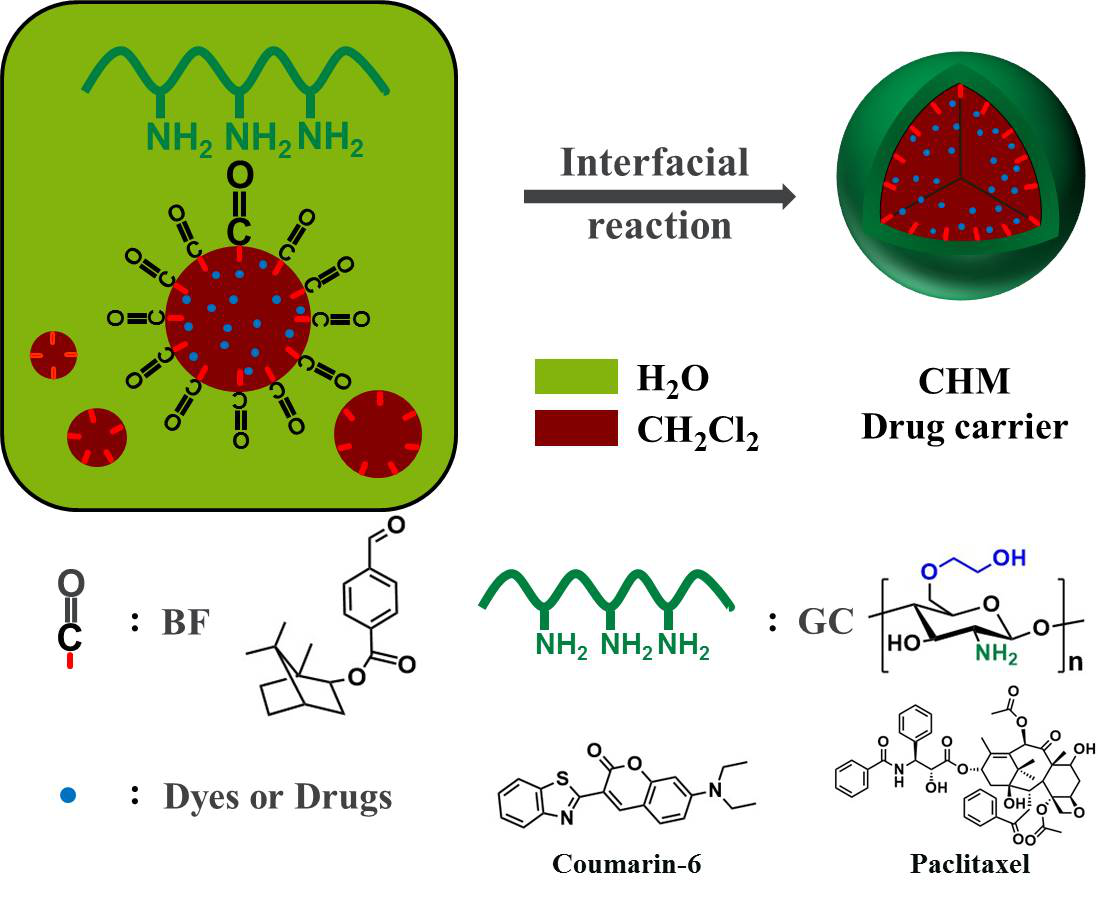
图1. 油水乳液界面席夫碱键合反应制备壳聚糖空心微球CHM药物载体。
论文第一作者付雅南博士通过实验证明,将初始制备的CHM通过0.22 μm的微孔滤膜,可以得到400-1000 nm尺寸分布的CHM。这一矛盾关系启发作者提出CHM微结构具有形变能力的科学假设(图2. A)。为了验证这个假设,作者对CHM过滤前后微孔滤膜的横截面分别进行了SEM断面分析(图2. B-D)。结果显示:CHM穿过0.22 μm微孔滤膜时,在原位发生明显的径向收缩(图2. D,红色箭头),证明了CHM的形状适应能力。

图2. (A)CHM的形状适应性假设示意图;(B, C)0.22 μm滤膜截面图,(D)微孔滤膜原位检测形状适应性转变的CHM(红箭头及轮廓线)。
作者认为,CHM的适形性首先有利于高效载药,模型实验证实了这一点,紫杉醇(PTX)的载药率和包封率分别为37.5%和75.0%(详见原文);其次,结合CHM表层壳聚糖的细胞亲和性,使其可被细胞快速有效摄取;进而,动态席夫碱键赋予了CHM智能响应性,即细胞外的稳定性和细胞内的快速响应释放行为。
以疏水性抗癌药物PTX为例,作者考察了PTX-CHM对两种癌细胞系:人源肝癌细胞(HepG2)和人非小细胞肺癌细胞系(A549)的体外毒性。MTT结果显示,当PTX浓度为10 μg·mL-1时,与游离PTX组相比, PTX-CHM组HepG2和A549细胞的存活率显著降低(图3. C)。48 h后,HepG2和A549细胞的存活率分别下降至9.4%和10.3%,从而证明了CHM作为疏水性抗癌药物载体的高效性。
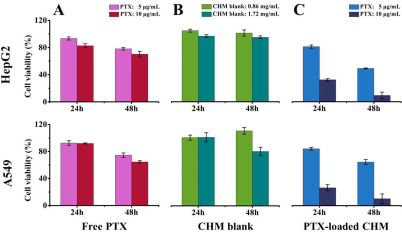
图3. MTT实验:(A)游离PTX组;(B)CHM空白组;(C)PTX-CHM载药组。
为了证明CHM载体的细胞摄取过程,作者利用共聚焦显微镜对CHM的吞噬和释药作用进行了细胞内原位实时监测(图4)。研究发现,HepG2细胞更倾向于通过丝状伪足(图4. A,红色箭头)而不是细胞膜(图4. A,黄色箭头)快速吞噬CHM载体。这与以前报道的内吞机制(阳离子壳聚糖微球的内化主要通过吸附性内吞作用发生)有所不同。幸运的是,作者发现这种席夫碱键构建的CHM载体可以在30 s内快速释放负载的药物(香豆素-6模型,图4. B)。这些现象不仅表明CHM很容易进入细胞,而且能够在细胞内快速响应释放。
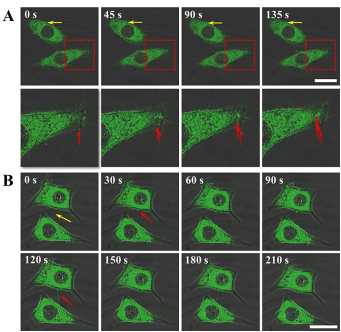
图4. (A)HepG2细胞摄取Cou-6-CHM;(B)香豆素-6从CHM快速释放。标尺25 μm。
该论文被期刊以封面文章(Cover Article)的形式亮点推送报道。基于席夫碱构建的CHM具有易于制备、成本低但效率高的优点,其独特的组装策略使CHM成为一种新型的具有形状适应能力的智能药物载体,其形状适应性可以为体内长循环和跨生物屏障的药物递送提供新的机会,有望在药物控制递送中发挥积极作用。
以上相关成果发表在Biomacromolecules 2017, 18 (7), 2195–2204。论文的第一作者为北京化工大学生命科学与技术学院博士生付雅南,通讯作者为王兴教授。
论文链接:https://pubs.acs.org/doi/abs/10.1021/acs.biomac.7b00592
- 四川大学何斌/蒲雨吉 ACS Nano:高分子化丁酸纳米平台治疗肠炎 2023-12-24
- 华南理工朱伟 Adv. Sci.:基于红细胞和MOF-级联酶的人工生物杂化体用于高尿酸血症治疗 2023-12-17
- 长期有效 | 西南交大周绍兵教授团队诚招博士、推免硕士 - 材料、生物医学工程 2023-09-23
- 江南大学付少海/王冬团队 Small:原位矿化生成的双网络结构壳聚糖复合气凝胶用于替代石油基保温材料 2025-10-27
- 暨大刘明贤教授团队 Bioact. Mater.: 纳米粘土增强的3D打印壳聚糖水凝胶用于止血与感染伤口修复 2025-08-28
- 新疆大学吐尔逊·阿不都热依木教授团队 J. Hazard. Mater./CEJ:壳聚糖基分子印迹电化学传感器的构筑及其性能研究 2025-08-06
