随着生命科学和医学的发展,越来越多的大分子药物问世,使得基因编辑以及转录水平调控成为可能。然而,对于这些大分子药物而言,生物利用度低一直是限制其发展的一个瓶颈问题。所谓生物利用度低,是指这些大分子会被生物体内的各种天然屏障所困,从而最终到达病灶部位的药物浓度很低。这些天然屏障本来是生物在进化过程中形成的自我保护机制,然而同时也使很多药物递送异常困难。
细胞膜就是这样一种生物天然屏障。与传统小分子药物不同,核酸和蛋白类大分子无法通过进入细胞,只能依赖细胞内吞机制。但内吞之后的核内体囊泡(endosome)会与溶酶体结合,从而使大分子失活。所以,提高大分子药物生物利用度的一个关键,就是开发一种能够辅助脱离核内体的药物载体。
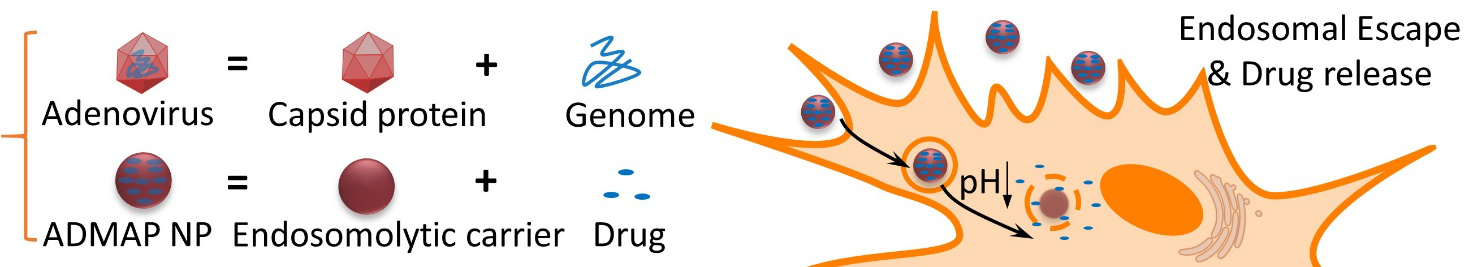
针对这个问题,芬兰赫尔辛基大学药学院Hélder Santos课题组,爱沙尼亚Tartu大学Tambet Teesula课题组以及泰国宋卡王子大学的合作研究者合成出了一种模拟病毒结构的聚合物纳米颗粒(ADMAP)。ADMAP以缩醛化天然葡聚糖(AcDX)为核心,模拟病毒的遗传物质载荷;另外在AcDX上用可逆加成-断裂链转移聚合(RAFT)接枝甲基丙烯酸月桂酯-甲基丙烯酸(LMA),模拟病毒的衣壳蛋白。当ADMAP被细胞内吞之后,核内体的酸性环境会使LMA质子化,从而诱导和细胞膜的相互作用,使得核内体膜通透性变强。这种质子化诱导的高分子和膜相互作用与病毒表面衣壳蛋白的功能非常相似。同时酸性环境也会使AcDX水解,从而触发药物释放。
ADMAP聚合物可通过在AcDX上可逆加成-断裂链转移聚合(RAFT)接枝甲基丙烯酸月桂酯-甲基丙烯酸实现。聚合物合成之后,通过在微流控芯片上的可控纳米沉积法得到均一的纳米粒。药物负载也可以通过纳米沉积法在同一种芯片上完成,最终达到80.7%的包封率。与游离药相比,ADMAP负载的抗肿瘤药物对于肠癌细胞CT-26的杀伤效果更好,特别是表面修饰肿瘤穿透肽以后,纳米粒可以穿透3D肿瘤球,并最终实现肿瘤球的裂解。
以上成果发表在最新一期Advanced Functional Materials上。论文的通讯作者为赫尔辛基大学博士后李威,王诗琪和Hélder Santos教授。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.201905352
- 中国科大陈昶乐/安大陈敏、张文建 Angew:ROMP-RAFT串联聚合新方法制备聚烯烃多嵌段共聚物 2025-07-02
- 西北师大王荣民教授Macromolecules:“Graft from”RAFT和超分子主客体化学制备聚(香草醛)抗微生物纳米环 2025-06-11
- 浙理工邵建中、黄益/蒙纳士大学San H. Thang《Small》:RAFT乳液聚合制备嵌段共聚物胶体微球构建液态光子晶体 2025-02-25
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
- 东南大学葛丽芹教授与合作者 Research:微气泡为模板的免疫活性金属多酚胶囊用于药物递送和增强的肿瘤免疫治疗 2025-07-31
- 四川大学丁明明教授团队 Angew: 可视化β折叠到β转角构象转变的荧光聚合物囊泡及其用于颜色报告型药物递送 2025-07-11
- 吉林大学钱虎军教授团队 PRL:单链纳米粒子突破高分子材料“强度-韧性-加工性”三难困境 2025-10-15
