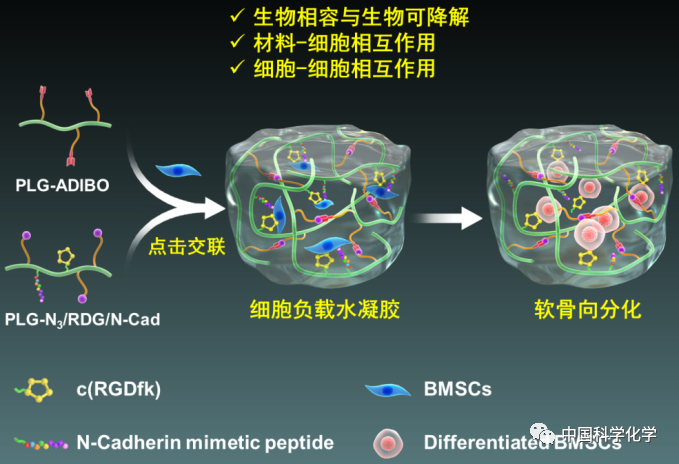
中科院长春应化所陈学思院士、贺超良研究员团队以构建生物活性与生物可降解3D细胞培养水凝胶支架材料为主题,设计制备了一种无催化“点击”反应交联的聚(L-谷氨酸)(PLG)水凝胶。通过同时将细胞黏附肽c(RGDfK)和神经钙粘素模拟肽键合到水凝胶网络中,实现了对水凝胶体系中材料-细胞及细胞-细胞之间双重相互作用的调节。采用该生物活性水凝胶为支架材料,显著促进了骨髓间充质干细胞(BMSCs)在水凝胶表面的黏附,以及干细胞在凝胶内的软骨向分化。该研究为构建多重生物功能化3D细胞培养平台提出了一种新的方法。
水凝胶是一种亲水性或双亲性的三维网状聚合物材料。因其水分含量高,并可以为细胞提供类似于天然细胞外基质的微环境,在组织工程和再生医学领域有巨大的应用潜力。目前,研究者们已经开发了多种可用于制备水凝胶的天然和合成高分子,其中合成高分子具有组成和化学结构明确、免疫原性低、机械性能可调节等优势。由天然来源的α-氨基酸-N-羧基内羧酸酐开环聚合形成的合成聚肽(或聚氨基酸)具有良好的生物相容性、生物可降解性以及与天然蛋白质相似的仿生二级结构等优点。而且,部分氨基酸残基固有的羧基、氨基或羟基侧基有利于实现材料的功能化修饰。因而聚氨基酸水凝胶在3D细胞培养和组织工程支架方面的应用受到了越来越多的关注。
在以往的研究中,制备聚氨基酸水凝胶通常采用的交联方式包括辣根过氧化物酶/过氧化氢体系(HRP/H2O2)、成腙反应和EDC/NHS体系等,但是这些交联体系中所包含的过氧化氢、自由基、醛类或小分子化学交联剂难以避免会对水凝胶所负载细胞或生物活性物质产生一定的毒性。而生物正交反应,特别是无催化剂点击反应,凭借其快速、高效、高选择性以及良好的体内外生物相容性已成为一种新兴的交联策略。
另一方面,水凝胶的生物活性同样是显著影响其再生医学应用的关键因素。在诱导水凝胶负载的BMSCs软骨向分化的过程中,以前关注点多集中于调节细胞-材料相互作用,进而实现对干细胞分化行为的调控。然而研究表明,在干细胞分化早期,细胞聚集状态下的细胞-细胞相互作用对于细胞的命运同样具有重要影响,因此同时实现对于水凝胶3D细胞培养体系的材料-细胞及细胞-细胞双重相互作用的有效调节,对于干细胞行为的更精确调控具有重要意义。然而,目前相关研究报道较少。
近期,陈学思院士、贺超良研究员团队将分别由叠氮与环辛炔衍生物修饰的PLG在生理条件下混合,通过自发的叠氮-环辛炔环加成反应,制备了PLG水凝胶。该无催化剂点击交联方法反应条件温和、高效,具有良好的生物相容性。BMSCs在水凝胶内部体外培养时,能保持高存活率;而当水凝胶注射到大鼠皮下后,10周内可完全降解,并表现出良好的组织相容性。进一步通过在PLG侧链同时接枝细胞黏附肽(c(RGDfK))与神经钙黏素模拟肽(N-cad),可改善水凝胶体系的生物活性。神经钙黏素能够依靠同源相互作用介导细胞-细胞连接和信号交流,而含有组氨酸-丙氨酸-缬氨酸(HAV)结构域的合成短肽N-cad已被报道具有神经钙黏素相近的结合特性。该研究结果证明,当这两种多肽共价连接到PLG水凝胶体系后,一方面显著促进了BMSCs在水凝胶表面的黏附以及软骨细胞在水凝胶内部的增殖;另外在诱导培养BMSCs软骨向分化过程中,N-cad的引入显著增加了水凝胶中软骨特异性基质的产生以及软骨生成相关基因和蛋白的表达。该研究为构建多重生物功能化3D细胞培养平台提出了一种新的方法。
该工作近期发表于Sci. China Chem.。论文第一作者为长春应化所博士研究生荣岩,通讯作者为贺超良研究员。详见:Yan Rong, Zhen Zhang, Chaoliang He*, Xuesi Chen. Bioactive polypeptide hydrogels modified with RGD and N-cadherin mimetic peptide promote chondrogenic differentiation of bone marrow mesenchymal stem cells. Sci. China Chem., 2020, DOI: 10.1007/s11426-020-9772-0.
原文链接:https://doi.org/10.1007/s11426-020-9772-0
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
- 北京化工大学王兴/李国锋团队《ACS AMI》:通过聚氨基酸纳米粒子现场递送抗生素消灭细胞内持留性金黄色葡萄球菌 2025-08-16
- 宁波大学陈重一教授 ACS Macro Lett.:基于螺旋结构聚氨基酸的强力生物粘合剂 2025-03-07
- 四川大学孙静/范红松团队 ACS Nano:兼顾抗菌活性与细胞保护功能的类酶水凝胶用于细菌性角膜炎中的角膜再生 2026-03-05
- 新医大一附院盛伟斌教授/华科大马良教授 AFM:构建了仿生多功能水凝胶贴片-在脊髓损伤治疗方面取得新进展 2026-03-02
- 浙大郑强/太原理工朱凤博团队 CEJ:碱激发粉煤灰催化的强韧复合水凝胶的可持续与规模化制备及其应用 2026-02-28
