肿瘤渗透是纳米药物实现高疗效需要克服的主要瓶颈。前期研究表明,能够被肿瘤细胞表面过表达的酶特异性水解并产生正电荷的聚合物药物载体可触发肿瘤细胞进行高效转胞吞,进而能够高效渗透浸润实体瘤,获得优异的抗肿瘤疗效。然而,聚合物的分子结构与酶响应能力、电荷反转性质、肿瘤渗透以及药物递送效率之间的关系尚不明确。
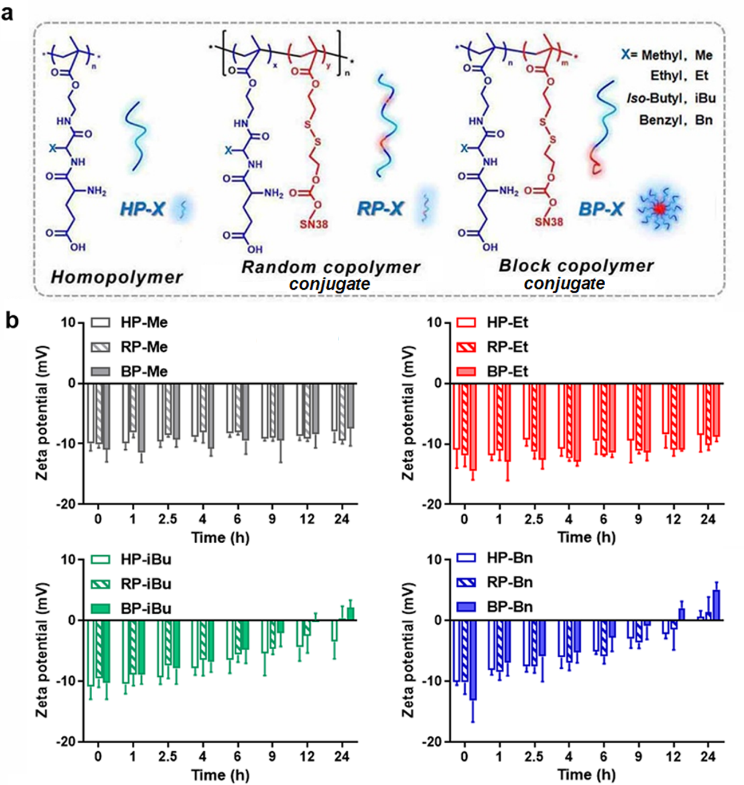
图1 APN响应聚合物的结构与电荷反转性质

图2 APN响应聚合物的细胞内吞、转胞吞及肿瘤球渗透
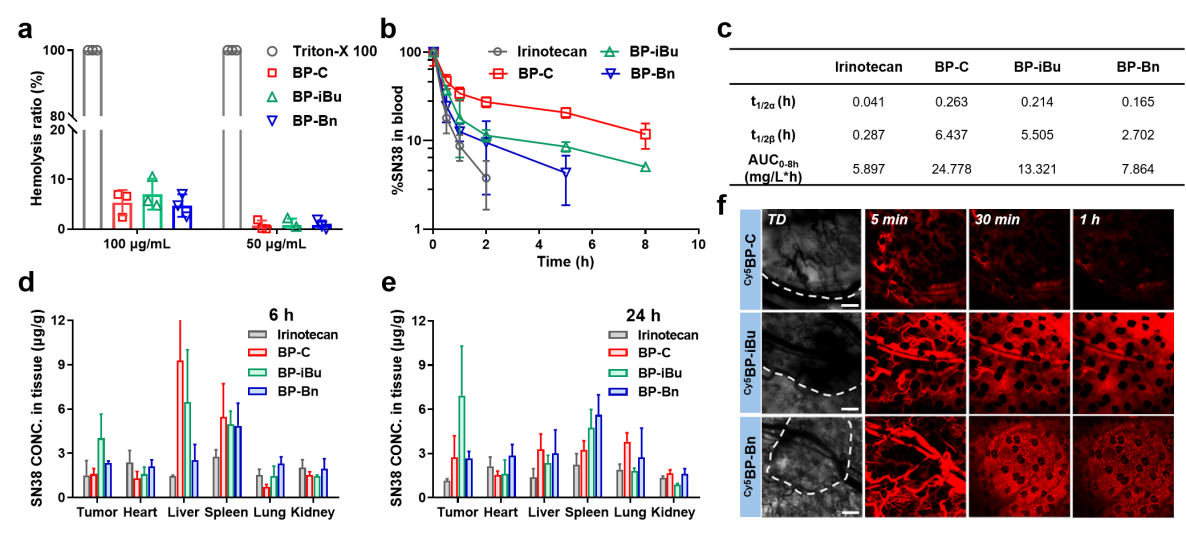
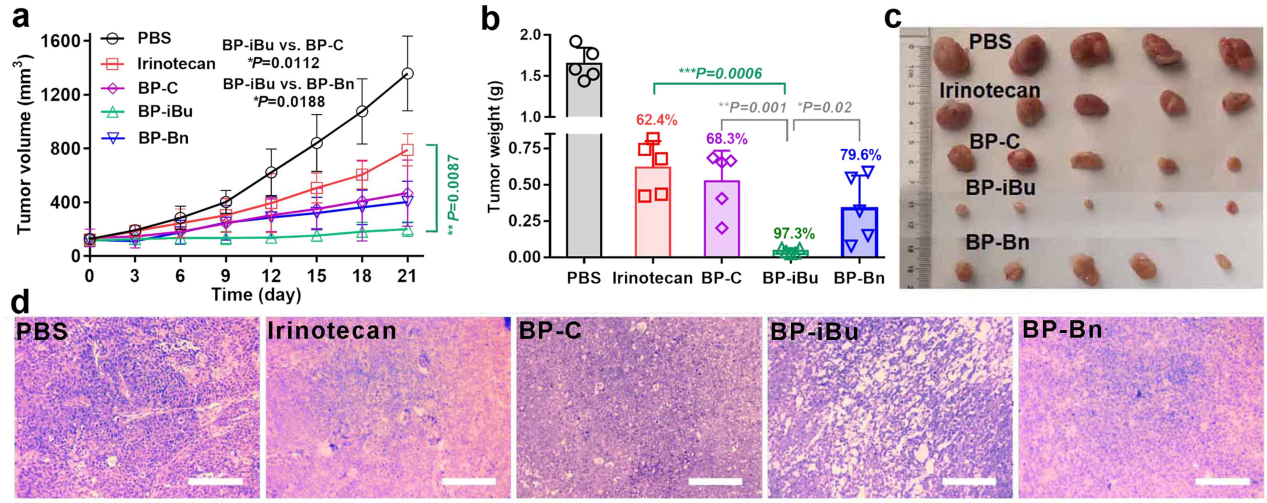
图4 APN响应聚合物的抗肿瘤效果
体内研究表明,电荷反转速率最快的BP-Bn虽然有较好的肿瘤渗透能力,但由于其较强的疏水性因而在血液循环系统内清除较快,导致其在肿瘤内蓄积能力较少。而电荷反转速率适中的BP-iBu,有较长的血液循环时间,能够同时实现高效的肿瘤渗透和药物蓄积,因此具有最佳的抑瘤效果。
该工作表明,合理调控电荷反转速率是改善整体药物递送效率的关键。该工作通过调整酶响应聚合物的结构,实现了高效的肿瘤渗透和蓄积,显著提高了抗肿瘤治疗效果,明确了酶响应电荷反转载体结构与性能的关系,为后续设计酶响应型高疗效抗癌纳米药物提供了坚实的基础。
论文信息:
Aminopeptidase N-Responsive Conjugates with Tunable Charge-Reversal Properties for Highly Efficient Tumor Accumulation and Penetration
Rui Sun,Yifan Zhang, Xiaowei Lin, Ying Piao, Tao Xie, Yi He, Jiajia Xiang, Shiqun Shao, Quan Zhou, Zhuxian Zhou, Jianbin Tang, Youqing Shen
Angewandte Chemie International Edition
https://doi.org/10.1002/anie.202217408
- 东华大学陈志钢教授团队《ACS AMI》:酶响应聚合物纳米颗粒用于内-外源动态刺激下的肿瘤治疗 2022-06-30
- 华科大王勇研究员团队 JACS:有机硼介导的有氧串联聚合新策略-构建嵌段共聚物一锅法合成通用平台 2026-03-04
- 四川大学牛艳华教授/李光宪教授团队《Macromolecules》:弱有序聚离子液体嵌段共聚物的黏弹行为和离子传输特性 2025-12-27
- 华南理工大学王林格教授团队 Small:时间分辨小角 X 射线揭示聚合诱导自组装两嵌段共聚物胶束的生成机制 2025-09-09
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
