“化敌为友”:澳门大学代云路团队研发焦亡型放疗药物
2023-03-20 来源:高分子科技
放射疗法作为传统的癌症治疗手段,其功效已在各种类型的癌症治疗中得到了认可。然而,传统放疗方式往往局限于局部病灶的治疗,并帮助肿瘤细胞重塑免疫抑制微环境,因而对恶性肿瘤的转移及复发治疗效果十分有限。究其原因,放射疗法主要通过引发细胞凋亡来抑制肿瘤细胞生长,而这种死亡方式在激发机体的抗肿瘤免疫反应方面可能设置诸多障碍。近期,澳门大学代云路团队通过将天然多酚和化学合成的多酚衍生物与金属离子配位,构建了一种金属-多酚配位纳米药物PWE,通过表观遗传学的方法将放射治疗介导的细胞凋亡转换为细胞焦亡,进而激发系统性抗肿瘤免疫反应。
该研究中构建的两亲性PEG-多酚聚合物和DNA 甲基转移酶抑制剂(表没食子儿茶素,EGCG)能与放疗增敏剂(钨离子,W6+)通过金属-多酚配位方法自组装成核壳结构的放疗增敏药物PWE。在肿瘤细胞内,EGCG通过抑制DNA甲基化诱导细胞焦亡的关键蛋白-GSDME高表达;同时金属W6+在X 射线辐照下产生大量的活性氧,由此激活的半胱天冬酶-3(Caspase-3)可进一步将GSDME 蛋白进行切割并引发细胞焦亡。细胞水平和动物实验结果显示,该种疗法激发了机体内的抗肿瘤免疫响应,显著促进了传统放疗的治疗效果。
纳米药物PWE组的肿瘤细胞在接受X射线辐照后,呈现出焦亡的一大特征-产生大大的气泡,并将免疫源性内容物迅速释放到胞外,最终走向死亡。

该研究中构建的两亲性PEG-多酚聚合物和DNA 甲基转移酶抑制剂(表没食子儿茶素,EGCG)能与放疗增敏剂(钨离子,W6+)通过金属-多酚配位方法自组装成核壳结构的放疗增敏药物PWE。在肿瘤细胞内,EGCG通过抑制DNA甲基化诱导细胞焦亡的关键蛋白-GSDME高表达;同时金属W6+在X 射线辐照下产生大量的活性氧,由此激活的半胱天冬酶-3(Caspase-3)可进一步将GSDME 蛋白进行切割并引发细胞焦亡。细胞水平和动物实验结果显示,该种疗法激发了机体内的抗肿瘤免疫响应,显著促进了传统放疗的治疗效果。
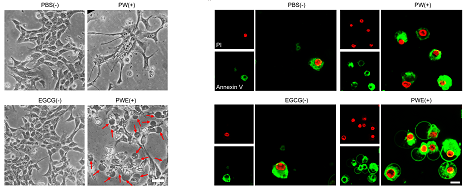
纳米药物PWE组的肿瘤细胞在接受X射线辐照后,呈现出焦亡的一大特征-产生大大的气泡,并将免疫源性内容物迅速释放到胞外,最终走向死亡。

在乳腺癌原位移植瘤小鼠模型中发现,PWE 联合X射线辐照可以通过介导细胞焦亡显著促进CD8+ T细胞的激活,抑制免疫调节T细胞的功能,并增强机体对乳腺癌的免疫记忆。
参考文献:Guohao Wang, et al. A Metal–Phenolic Nanocoordinator Launches Radiotherapeutic Cancer Pyroptosis Through an Epigenetic Mechanism. Adv. Funct. Mater., 2023, DOI: 10.1002/adfm.202213425

全文链接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202213425
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 澳门大学代云路课题组 Adv. Mater.:新型金属-多酚网络激活STING通路助力肿瘤放射治疗 2022-01-04
- 西南大学许志刚/武汉大学孙志军 Nano Today:内/外源调控肿瘤细胞焦亡的聚合物纳米诱导剂用于增效肿瘤免疫治疗 2023-01-11
- 长春应化所/厦门大学田华雨教授《Adv. Mater.》:生物矿化双酶纳米颗粒调控肿瘤糖代谢诱导肿瘤细胞焦亡和抗肿瘤免疫治疗 2022-10-07
- 温医大纪建松/苏大刘庄、冯良珠 Adv. Sci.:肿瘤碎片驱动的胆固醇靶向催化水凝胶可增强微波消融联合抗肿瘤免疫反应疗效 2024-12-16
- 澳门大学代云路课题组《Adv. Sci.》:自降解纳米凝胶通过药物再利用策略重塑肿瘤微环境以重新激活CD8? T细胞 2023-05-11
- 浙江大学高建青教授团队《ACS Nano》: 载微量光敏剂的可溶微针贴片激活抗肿瘤免疫反应用于原位及远端黑色素瘤的治疗 2021-12-06
