澳门大学代云路课题组《Adv. Sci.》:自降解纳米凝胶通过药物再利用策略重塑肿瘤微环境以重新激活CD8? T细胞
2023-05-11 来源:高分子科技

CD8+ T细胞因其强大的肿瘤杀伤能力而成为肿瘤免疫学研究的热点。大量证据表明,癌症免疫疗法的成功需要 CD8+ T 细胞的浸润和激活。然而,许多患者无法从当前的癌症免疫疗法中获益,因为免疫抑制性肿瘤微环境 (TME) 导致 CD8+ T 细胞缺乏抗肿瘤免疫反应。因此,恢复免疫抑制性 TME 以重新激活细胞毒性 CD8+ T 细胞的治疗策略可能会增强当前癌症免疫疗法的治疗效果。
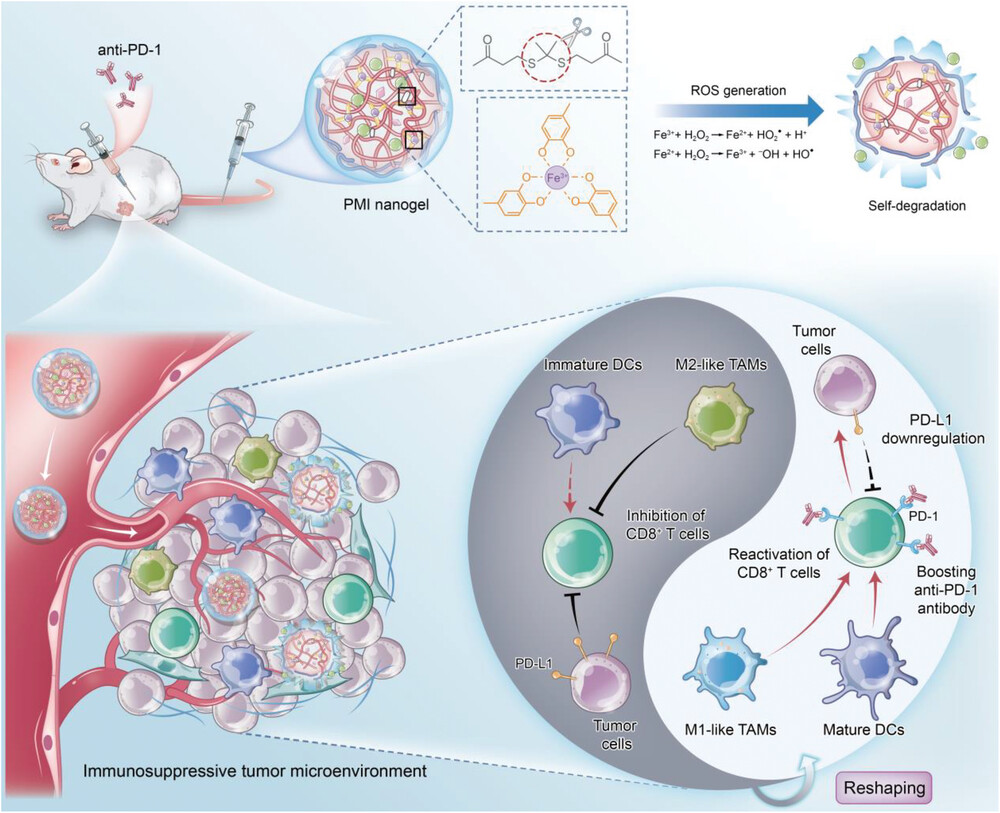
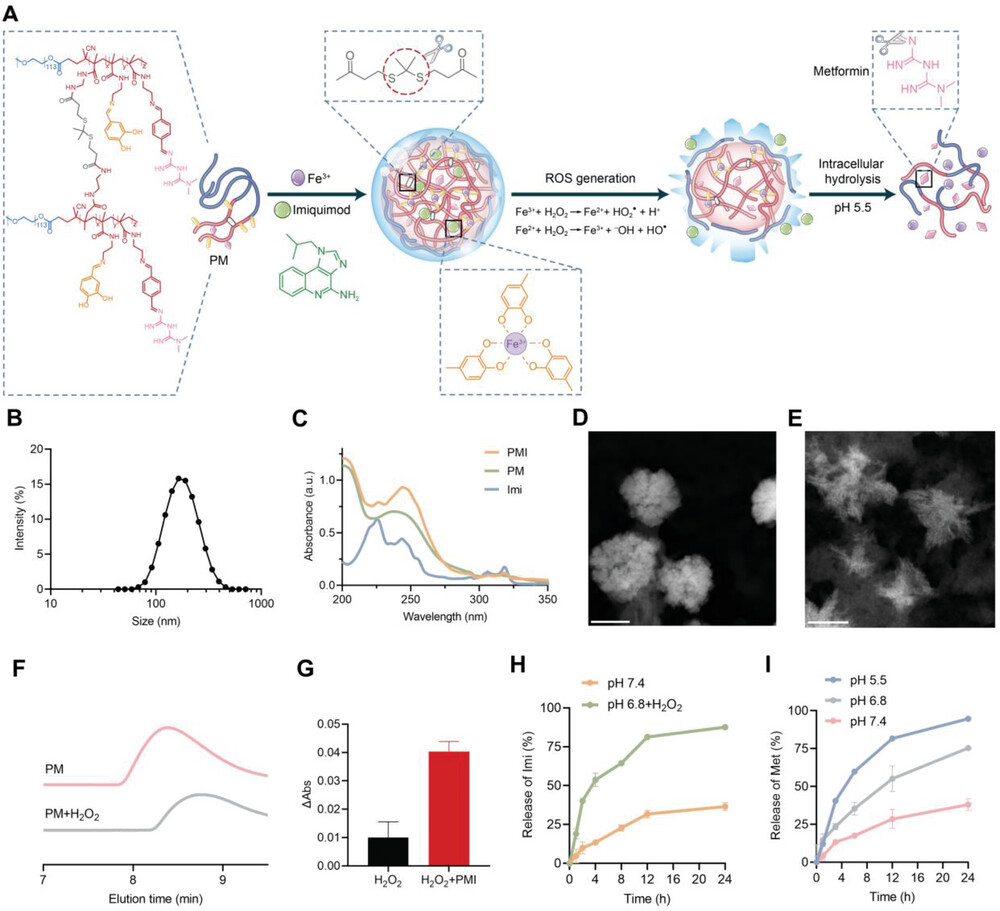
图2. PMI 纳米凝胶的表征。

图3. PMI纳米凝胶下调肿瘤细胞的PD-L1表达。
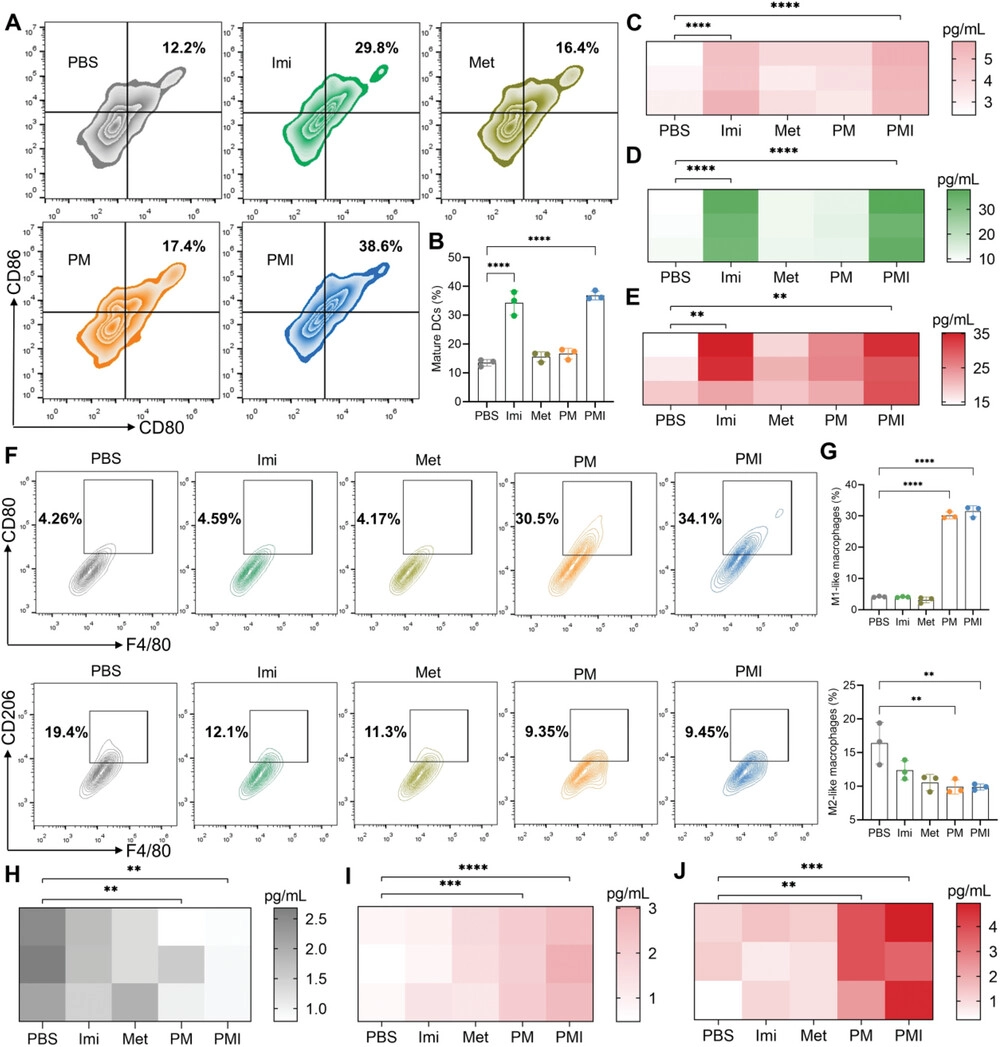
图4. PMI纳米凝胶在体外促进DCs成熟和巨噬细胞复极化。
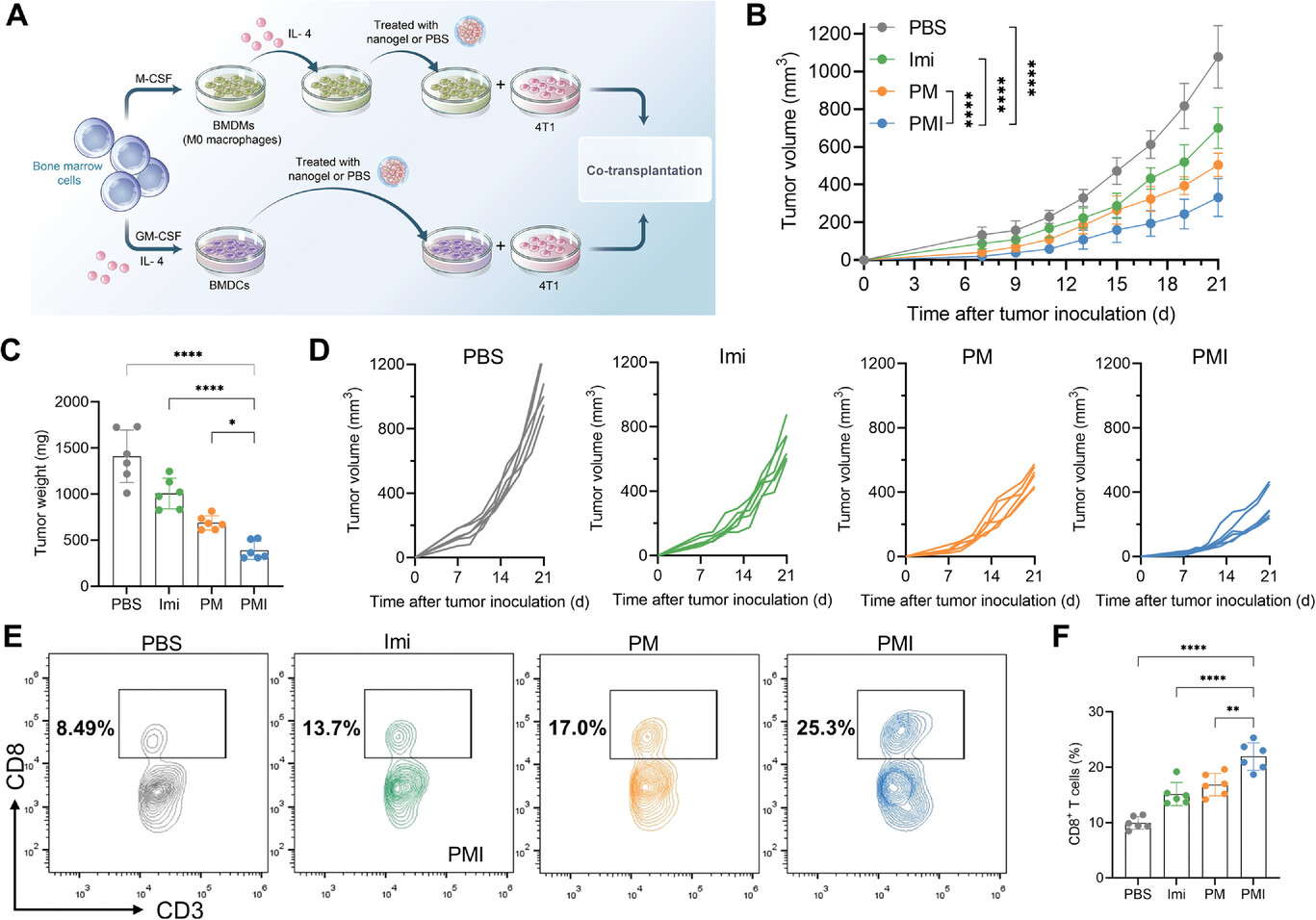
图5. PMI纳米凝胶在联合植入模型中重新激活了细胞毒性CD8+ T细胞。
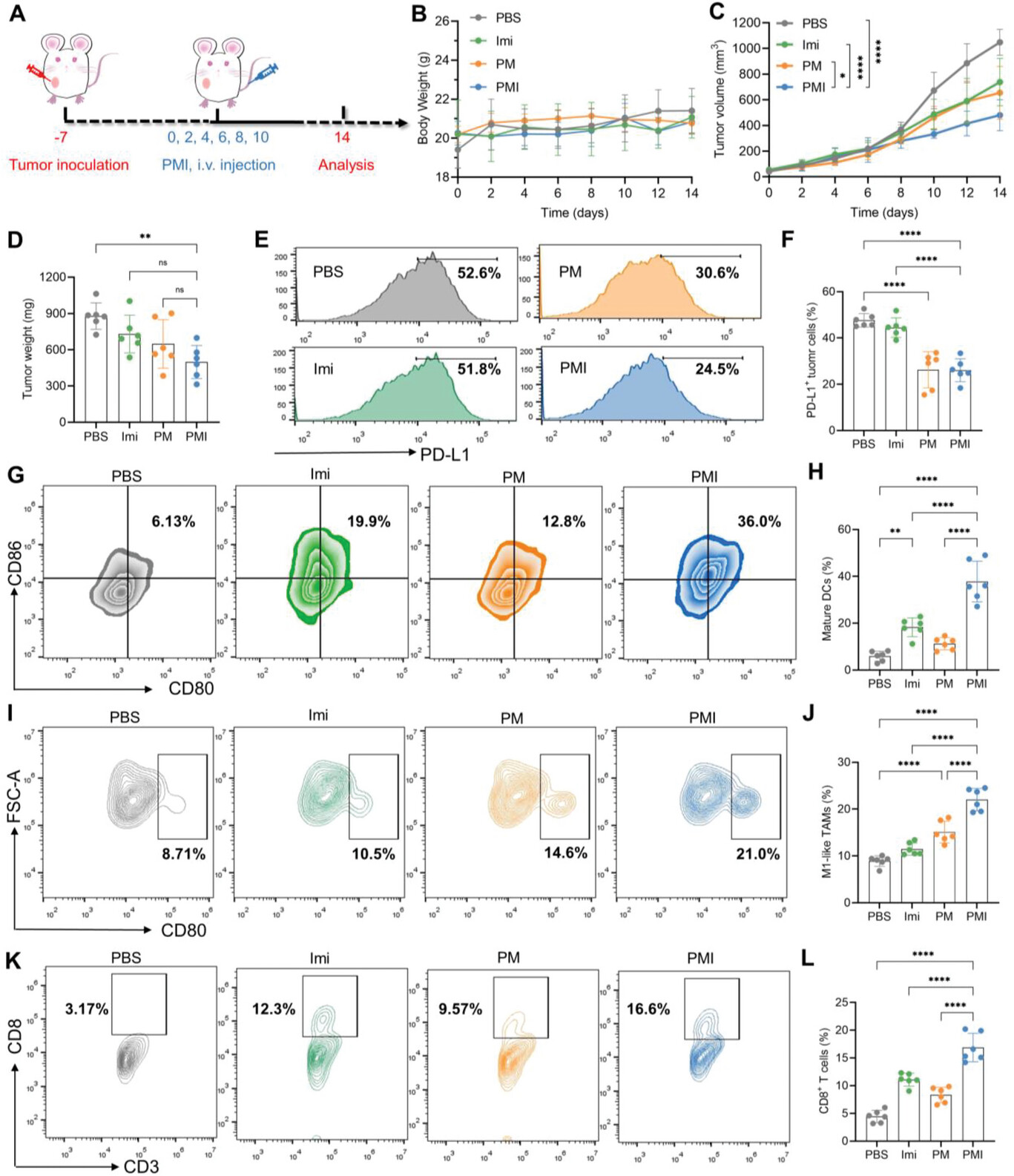
图6.PMI纳米凝胶充分重塑免疫抑制TME以重新激活细胞毒性CD8+ T细胞。

图7. PMI纳米凝胶通过重新激活细胞毒性CD8+ T细胞来提高PD-1抗体的治疗效率。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202301661
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 上海市第一人民医院马小军/东华大学何创龙 Bioact. Mater.:TME响应复合水凝胶靶向抑制MYC驱动型骨肉瘤生长与转移 2025-01-17
- 暨南大学戴箭课题组 Adv. Funct. Mater.:溶瘤病毒样纳米颗粒用于肿瘤特异性基因递送 2024-04-23
- 南方医科大学沈折玉教授、新加坡国立大学陈小元教授《Adv. Mater.》:一种用于MRI引导肿瘤铁死亡治疗的与逻辑门 2023-09-28
- 东华大学沈明武研究员/史向阳教授团队 AFM:仿生外泌体伪装的pH响应型树状大分子纳米凝胶作为疫苗通过重编程多种细胞类型治疗胰腺癌 2026-02-20
- 华科大李子福教授 Nat. Commun.:相变纳米凝胶赋能生物医学新突破 2025-12-22
- 山东大学栾玉霞教授团队 Nat. Nanotech.:发现解决CAR-T细胞疗法实体瘤疗效受限的有效方法 2025-05-20
- 温医大纪建松/苏大刘庄、冯良珠 Adv. Sci.:肿瘤碎片驱动的胆固醇靶向催化水凝胶可增强微波消融联合抗肿瘤免疫反应疗效 2024-12-16
