近期,天津大学化工学院仰大勇教授团队联合上海交通大学医学院附属仁济医院、上海市肿瘤研究所刘培峰教授团队,在基因药物递送方面取得新进展,设计发展了一种双酶响应的DNA纳米框架,实现了基因编辑CRISPR-Cas9系统和反义寡核苷酸(ASO)的可控递送,达到了基因编辑和基因沉默协同治疗的效果。相关成果发表于国际权威期刊《先进功能材料》(Advanced Functional Materials)。仰大勇教授和刘培峰教授为共同通讯作者,博士生宋纳川为第一作者。该工作得到国家自然科学基金委项目资助。
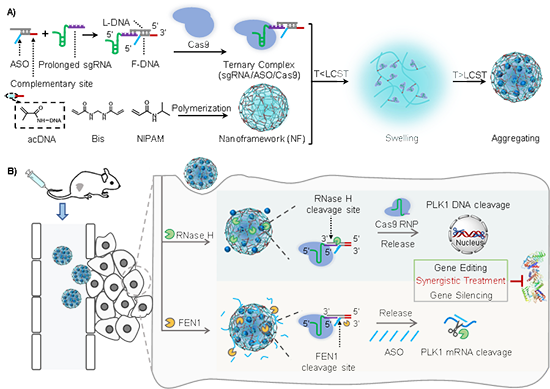
图1. 双酶响应的DNA纳米框架用于Cas9 RNP和ASO的共同递送和可控释放
研究团队利用沉淀聚合反应合成DNA纳米框架,高效负载Cas9 RNP和ASO,实现了在乳腺癌细胞中的可控释放,验证了基因编辑和基因沉默在细胞和活体水平的协同基因治疗。DNA纳米框架具有独特的相转变特性,并且修饰有能够与三元复合物(sgRNA/ASO/Cas9)碱基互补配对结合的DNA连接位点。在低温(4 oC)下,DNA纳米框架转变为溶胀态,暴露出框架内部的DNA连接位点,通过碱基互补配对结合三元复合物;当恢复至生理温度(37 oC)时,DNA纳米框架转变为凝聚态,实现对三元复合物的高效负载。三元复合物精准的分子设计能够响应癌细胞中过表达的核糖核酸酶H(RNase H)和瓣状核酸内切酶1(FEN1),通过特异性酶促切割反应实现Cas9 RNP和ASO的可控释放。Cas9 RNP介导的基因编辑和ASO介导的基因沉默实现了协同的基因治疗效果,在乳腺癌细胞及小鼠乳腺癌皮下瘤模型的治疗中取得了显著效果,并对正常细胞和组织具有良好的生物相容性。这种多功能DNA纳米框架为基因药物的高效可控递送提供了有潜力的解决方案,有望促进精准医疗的发展。
原文链接:https://doi.org/10.1002/adfm.202306634
仰大勇课题组以生物大分子DNA为研究主线,聚焦DNA生物功能材料化学组装与智能制造,探索在生命分析和疾病治疗中的应用。
- 天津大学仰大勇团队 Sci Adv:DNA纳米材料可控组装赋能肿瘤基因治疗 2023-09-04
- 天津大学仰大勇团队 Angew:胞内质子驱动DNA纳米框架组装干扰溶酶体功能 2022-06-25
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
- 东南大学葛丽芹教授与合作者 Research:微气泡为模板的免疫活性金属多酚胶囊用于药物递送和增强的肿瘤免疫治疗 2025-07-31
- 四川大学丁明明教授团队 Angew: 可视化β折叠到β转角构象转变的荧光聚合物囊泡及其用于颜色报告型药物递送 2025-07-11
- 杨万泰院士团队:自稳定沉淀聚合原理、方法及应用 2020-07-17
- 北化大教授杨万泰院士团队在聚合物纳/微粒子制备技术取得新突破 2018-11-29
