癌症疫苗因可以引发肿瘤特异性的免疫应答和长期的免疫记忆,近年来备受关注。但也面临着抗原免疫原性低和肿瘤异质性等问题,而造成抗肿瘤免疫效果有限,导致肿瘤治疗不彻底,容易复发和转移。虽然化疗、放疗或光疗等能引发机体产生自体肿瘤抗原,克服肿瘤异质性问题,但由于抗原体内存在时间有限,而无法引发机体强的持续的免疫反应。
针对以上问题,华中科技大学王芹教授课题组与朱艳红教授合作,基于仿贻贝强黏附性的儿茶酚基团,构建负载光热试剂MnO2纳米粒的温敏纳米凝胶(MnO2@PND),用于瘤内注射后原位形成凝胶捕获光热效应产生的肿瘤衍生蛋白抗原(TDPAs),形成“抗原库”,充当自体肿瘤疫苗,持续释放抗原,以增强抗肿瘤免疫反应。
该“抗原库”的形成机制及引发的抗肿瘤免疫应答示意图如图1所示。较高浓度MnO2@PND纳米凝胶分散体经瘤内注射后,原位形成宏观凝胶。在近红外光照射下,具有良好光热效应的MnO2纳米粒将光能转变为热能,引起肿瘤细胞发生免疫原性死亡,由此释放大量自体肿瘤衍生蛋白抗原,作为免疫刺激物,避免了肿瘤异质性问题。这些抗原被黏附性水凝胶捕获后,可避免被机体快速清除;捕获了抗原的水凝胶原位形成“抗原库”,持续释放抗原,招募更多的DCs来摄取抗原,并刺激T细胞转变成效应T细胞,由此激发机体强烈而持久的抗肿瘤免疫反应。

图1 “抗原库”形成机制及由此引发的抗肿瘤免疫应答示意图
该MnO2@PND温敏纳米凝胶首先由温敏性单体N-异丙基丙烯酰胺和含有儿茶酚结构的3-甲基丙烯酰多巴胺经自由基聚合而形成PND纳米凝胶,再通过原位矿化法负载上MnO2纳米粒而得到(图2a)。形成的PND和MnO2@PND的水化直径均约为200 nm(图2b-2e),MnO2@PND 结构采用红外、XPS和XRD等进行了确认,其低的临界溶解温度为29 °C(图2f, 2g)。由此得到的浓度为100 mg mL-1 的MnO2@PND水分散体在室温下为可流动的溶胶,在体温下因疏水作用增强而形成宏观凝胶(图2h, 2i)。
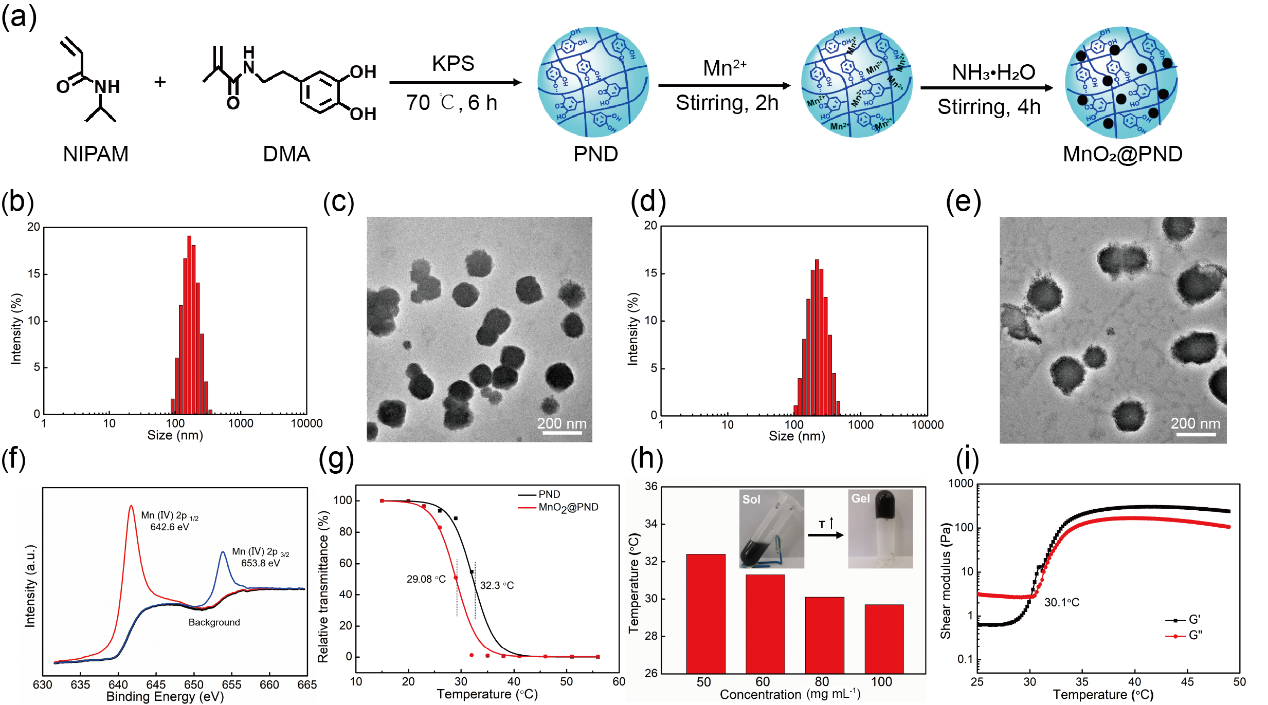
图2 MnO2@PND纳米凝胶的制备路线图与基本特性
a. MnO2@PND纳米凝胶的制备路线示意图;b. PND纳米凝胶的水合粒径分布;c. PND纳米凝胶的TEM照片;d. MnO2@PND纳米凝胶的水合粒径分布;e. MnO2@PND纳米凝胶的TEM照片;f. MnO2@PND中Mn的X射线电子能谱分析图谱;g. MnO2@PND纳米凝胶的温敏性;h. 浓度对MnO2@PND纳米凝胶分散体溶胶-凝胶转变温度的影响;i. MnO2@PND纳米凝胶分散体的储能模量G′和损耗模量G′′随温度的变化。
MnO2@PND纳米凝胶以及由此形成的宏观水凝胶因儿茶酚结构的存在而对模型蛋白和TDPAs均有良好的吸附性(图3a-e)。MnO2@PND水凝胶对含有TDPAs的蛋白吸附量为不含儿茶酚基团的凝胶(MnO2@PNI)的2倍以上。捕获了TDPAs的凝胶皮下注射后可招募更多的DCs汇集到注射点附近(图3f,3g),并刺激更多的DCs成熟(图3h,3i)。
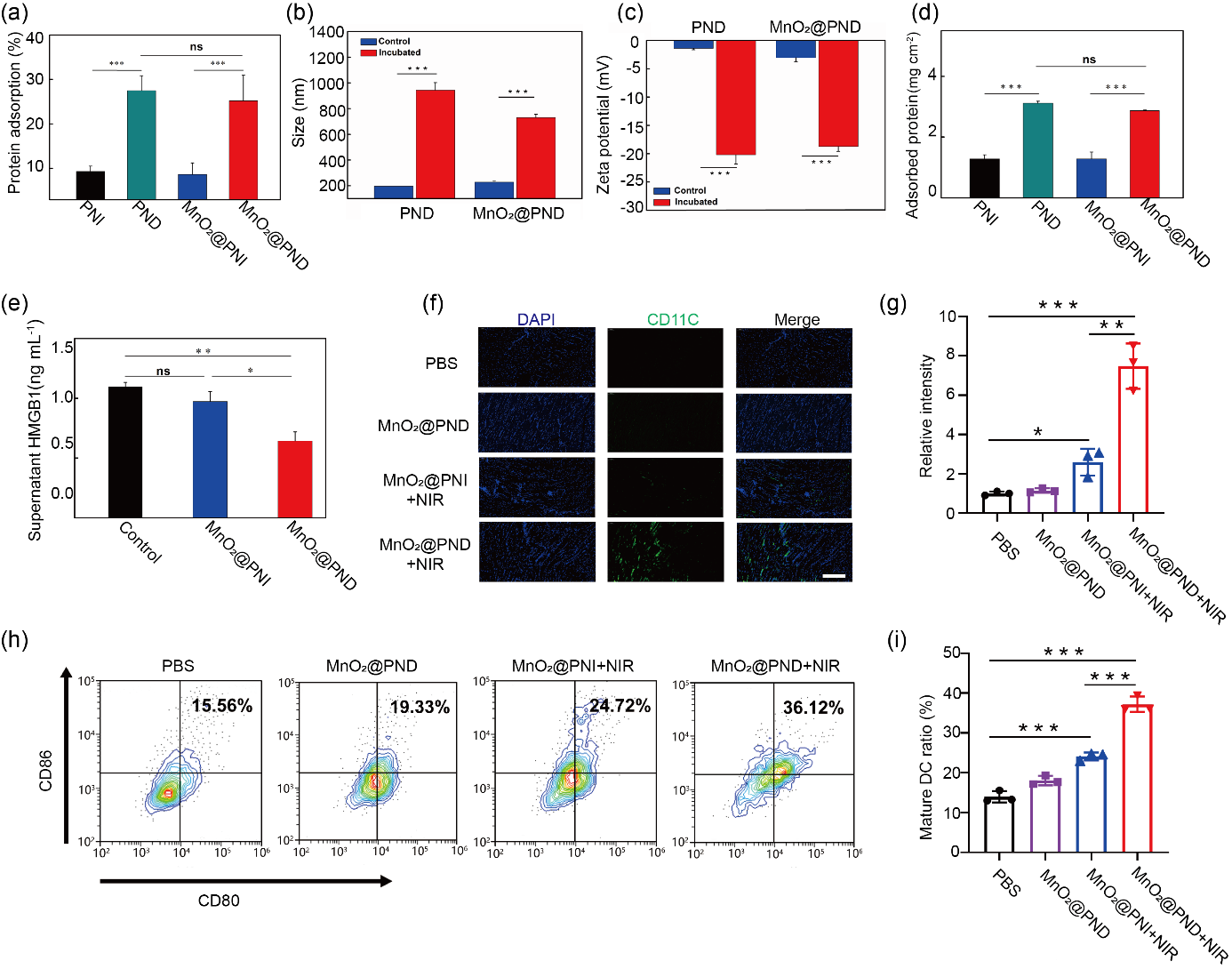
图3 体外MnO2@PND的“抗原捕获”及免疫刺激作用
a. 形成的MnO2@PND水凝胶对胎牛血清中蛋白的吸附比例;b. MnO2@PND纳米凝胶粒径在与肿瘤细胞裂解液孵育前后的变化;c. 肿瘤细胞裂解液孵育前后MnO2@PND纳米凝胶Zeta电位的变化;d. 捕获的肿瘤裂解液中总蛋白的含量;e. 捕获后细胞裂解液上清中HMGB1的浓度;f. 捕获抗原的MnO2@PND体内注射5天后召集DCs免疫荧光代表图;g. 体内召集DCs免疫荧光强度统计图;h. 捕获抗原的MnO2@PND体外促进DCs成熟流式细胞代表图;i. 体外促进DCs成熟流式细胞统计图.
如图4a,对小鼠4T1乳腺癌皮下瘤进行治疗。结果表明,瘤内注射MnO2@PND水凝胶并结合NIR光热治疗后,可使原发肿瘤在治疗后第4天几乎完全消除且不复发(图4b-4d),并可有效激活机体的抗肿瘤免疫应答(3e-3h)。

图4 原发瘤治疗效果与免疫应答
a. 原发瘤治疗过程示意图;b. 肿瘤生长曲线;c. 不同时间点各组小鼠代表性照片;d. 肿瘤照片(第14天);e. 治疗5天后肿瘤引流淋巴结中成熟DCs流式细胞代表性图片及f. 成熟DCs占比流式统计图;g. 治疗14天后血清中的干扰素-γ(IFN-γ)水平和h. 血清中的肿瘤坏死因子(TNF-α)水平.
这种可注射黏附性水凝胶经瘤内注射,在NIR激光照射捕获了自体肿瘤抗原后,可在肿瘤部位存在长达14天以上,由此激发持久而强烈的抗肿瘤免疫反应,可使机体在未使用任何免疫佐剂或免疫检查点抑制剂的情况下,仍能显著抑制远端肿瘤和再次接种肿瘤的生长。如图5所示,荷瘤鼠被治疗后第40天,在对侧皮下再次接种肿瘤细胞,相较于利用手术切除和非抗原捕获凝胶光热治疗的小鼠,基于MnO2@PND光热治愈的小鼠的再接种瘤被显著抑制(图5b-5d),这可归因于小鼠体内产生了较多的效应记忆T细胞(图5e,5f)和较高水平的抗肿瘤细胞因子(图5g-5j)。
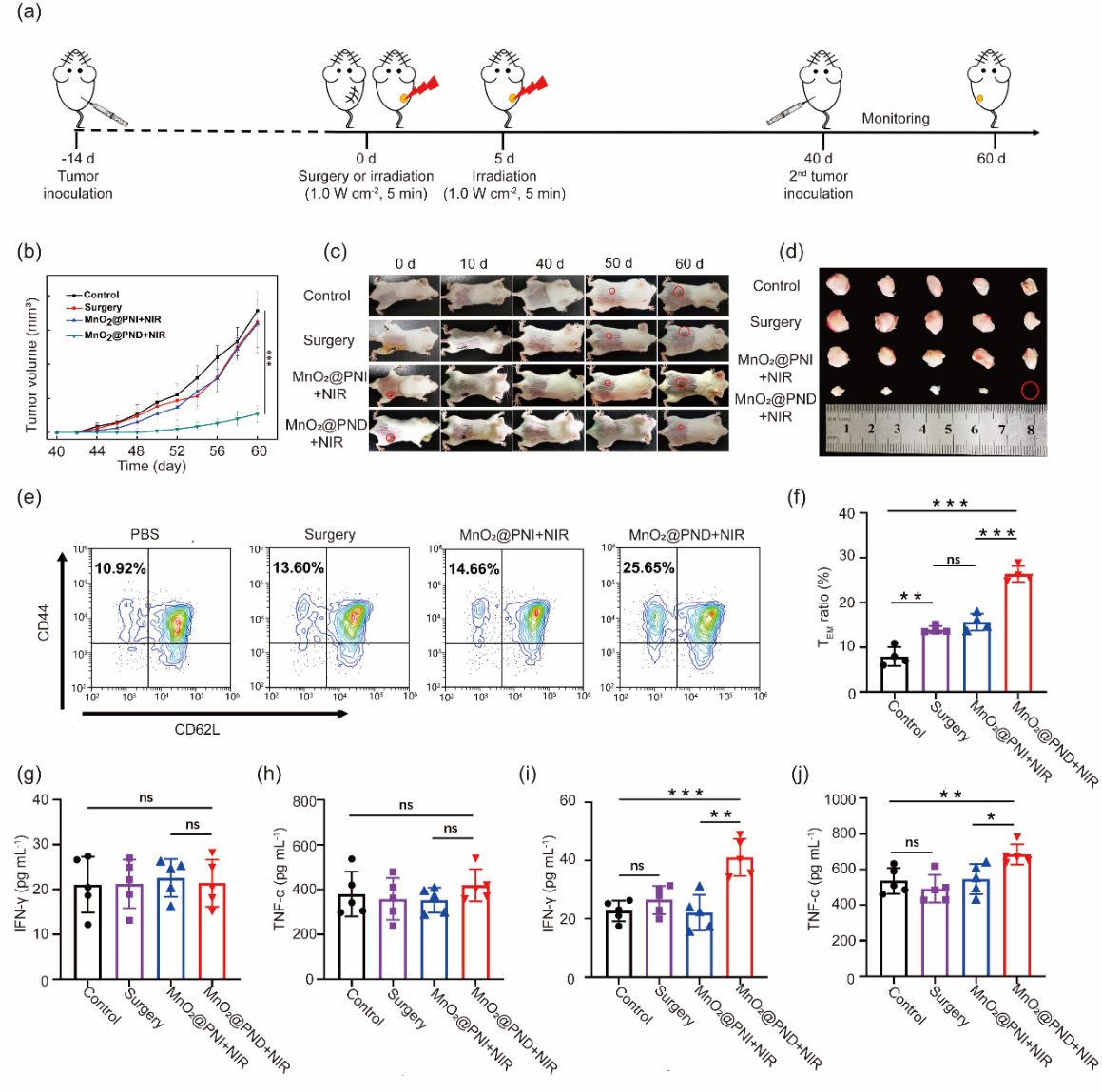
图5 再次接种种瘤治疗效果
a. 再次接种肿瘤治疗过程示意图;b. 再种瘤肿瘤生长曲线;c. 不同时间点各组小鼠代表性照片;d. 肿瘤照片(第60天);e. 首次治疗40天后脾脏中效应记忆T细胞流式细胞代表图;f. 根据流式细胞图统计的效应记忆T细胞百分含量;g. 血清中的干扰素-γ(IFN-γ)水平(第30天);h.血清中的肿瘤坏死因子(TNF-α)水平(第30天);i. 血清中的干扰素-γ(IFN-γ)水平(第45天);j. 血清中的肿瘤坏死因子(TNF-α)水平(第45天).
以上相关成果以 “Injectable Adhesive Hydrogel as Photothermal‐Derived Antigen Reservoir for Enhanced Anti‐Tumor Immune”发表在Advanced Functional Materials上。论文的第一作者为华中科技化学与化工学院博士生樊满,华中科技大学化学与化工学院王芹教授与生命科学与技术学院朱艳红教授为共同通讯作者。
论文链接:https://doi.org/10.1002/adfm.202010587
- 四川大学孙静/范红松团队 ACS Nano:兼顾抗菌活性与细胞保护功能的类酶水凝胶用于细菌性角膜炎中的角膜再生 2026-03-05
- 新医大一附院盛伟斌教授/华科大马良教授 AFM:构建了仿生多功能水凝胶贴片-在脊髓损伤治疗方面取得新进展 2026-03-02
- 浙大郑强/太原理工朱凤博团队 CEJ:碱激发粉煤灰催化的强韧复合水凝胶的可持续与规模化制备及其应用 2026-02-28
- 北京化工大学蔡晴/喻盈捷 AFM:三重生物粘附性微球赋能金属离子工程化外泌体疗法,实现血管化骨再生 2026-02-18
- 南京林业大学杨蕊副教授 Carbohyd. Polym.:木基高强度粘附性导电水凝胶用于柔性传感器 2025-09-28
- 苏大钟志远/邓超、苏大附一院朱晓黎 Nat. Commun.:肿瘤血管适应性、粘附性和可吸收性微球用于可持续的经动脉化学栓塞治疗 2025-07-09
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
