作为常用的临床成像技术,计算机断层扫描(CT)成像具有优异的空间和密度分辨率,而磁共振(MR)成像能提供高灵敏度和卓越的软组织对比度。然而,因为单一模态成像具有内在的优点和不足,仍然难以获取全面准确的肿瘤诊断信息。为解决这一问题,CT/MR双模态成像技术引起人们的重视。然而,基于小分子的常规造影剂缺乏肿瘤特异性,代谢快,高浓度时产生肾毒性。因此,开发具有特异性肿瘤靶向能力的CT/MR双模态成像纳米探针至关重要。
由于纳米级的颗粒或者药物普遍在实体瘤组织具备高渗透长滞留的EPR效应,因此构建合适的纳米探针材料通过放大其EPR效应,可大大提高其成像诊断灵敏度和准确度。聚酰胺-胺(PAMAM)树状大分子是一类高度支化的、三维立体结构的单分散大分子。由于其具有良好水溶性、非免疫原性和易官能化等优点,沈明武研究员/史向阳教授课题组在前期研究中,利用第5代(G5)或第2代(G2)PAMAM树状大分子负载双模态造影剂,用于肿瘤的CT/MR或SPECT/CT成像(ACS Appl. Mater. Interfaces 2019, 11, 15212?15221;ACS Appl. Mater. Interfaces 2016, 8, 19883?19891)。然而基于单个树状大分子的纳米探针材料尺寸相对较小,使得其EPR效应受到限制。该团队最近的研究证实几何尺寸大于单代树状大分子的核壳结构树状大分子显示出比单个树状大分子纳米颗粒更高的肿瘤穿透能力和放大的肿瘤EPR效应(Biomacromolecules 2021, 22, 2181?2188)。
纳米水凝胶作为一种由高分子链通过物理或化学交联形成的高度亲水的三维网络结构,同时展现出了纳米颗粒及水凝胶所具有的特性:(1)高流动性和柔韧性,能够更好地穿过血管上皮细胞间间隙,进入肿瘤区域,从而被肿瘤细胞吞噬;(2)高亲水性,在体内可以保持相对较长的循环时间;(3)通过设计环境响应性的交联剂或高分子链,可实现纳米体系在体内特定区域的响应性释放,减少药物副作用。此外,已证明具有两性离子表面修饰的纳米粒子显示出优异的抗污性能,延长的血液循环时间,从而使纳米药物更容易被肿瘤细胞吞噬。基于前期的研究成果,该团队考虑结合树状大分子与纳米凝胶的优点及纳米凝胶的放大的EPR效应,合成了功能化树状大分子纳米凝胶用于增强肿瘤CT/MR双模态成像。
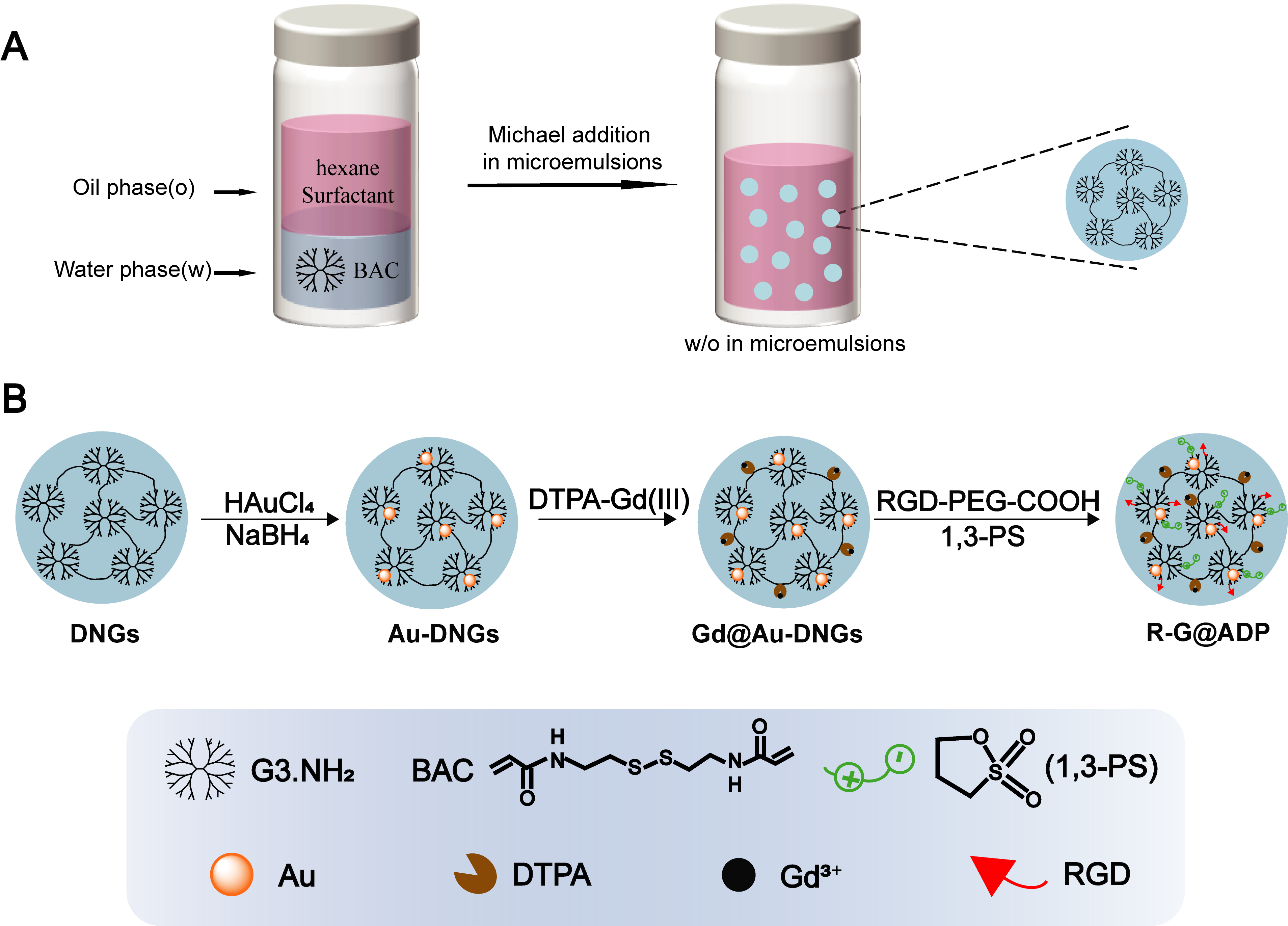
图1. 树状大分子纳米凝胶(A)和R-G@ADP(B)的合成示意图。


以上研究以“Multifunctional Low-Generation Dendrimer Nanogels as an Emerging Probe for a Tumor-Specific CT/MR Dual-Modal Imaging”为题,发表在美国化学会期刊Biomacromolecules (DOI: 10.1021/acs.biomac.2c01403)上。东华大学化学化工与生物工程学院硕士研究生徐旭为第一作者,东华大学史向阳教授、沈明武研究员为共同通讯作者。该工作得得到了国家自然科学基金委、上海市科委等项目的资助。
论文链接:https://doi.org/10.1021/acs.biomac.2c01403
- 太原理工大学刘旭光教授团队CEJ: 空隙自调节锂离子筛纳米水凝胶 2022-05-09
- 中科院苏州纳米所靳健研究员课题组在纳米水凝胶抗污染油水分离膜材料取得进展 2018-08-23
- 中科院合肥研究院吴正岩研究员课题组研制出纳米水凝胶为载体的pH控释农药 2017-11-15
- 东华大学沈明武研究员/史向阳教授团队 AFM:仿生外泌体伪装的pH响应型树状大分子纳米凝胶作为疫苗通过重编程多种细胞类型治疗胰腺癌 2026-02-20
- 东华大学沈明武研究员/史向阳教授团队:不对称含磷树状大分子递送菠萝蛋白酶用于骨关节炎的抗炎和软骨保护治疗 2025-06-13
- 东华大学史向阳教授团队:外泌体包裹的响应性树状大分子纳米凝胶可实现急性肺损伤的免疫调节和抗氧化联合治疗 2025-05-15
- 郑州大学曹少魁教授、刘应良副教授团队 Small:树枝状纳米聚合物构建超分子框架修饰稳定柔性钙钛矿阻变存储器 2023-01-03
