
嵌合抗原受体T(CAR-T)细胞免疫疗法在治疗血液系统恶性肿瘤方面取得了成功,而在实体瘤的治疗中仍远不能令人满意,其主要原因是传统的通过静脉输送的CAR-T细胞能优先被输送到靠近肿瘤的淋巴结和脾脏,而对于实体肿瘤,由于其存在复杂的肿瘤微环境,静脉回输的CAR-T细胞难以有效富集到肿瘤附近,难以达到有效的杀伤效果。
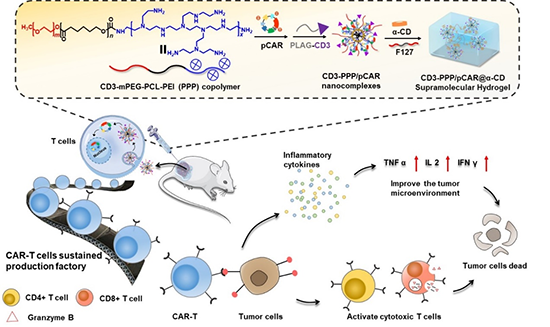
图1可注射超分子水凝胶剂型设计实现CAR-T细胞原位持续改造,促进实体瘤免疫治疗的示意图
近期,厦门大学吴云龙教授、吴彩胜教授设计了一种可注射的携带CAR质粒的(CD3-PPP/pCAR@α-CD)超分子水凝胶体系用于实体瘤部位CAR-T细胞原位持续改造(图1)。在该体系中,含T细胞特异性启动子的叶酸受体(FRα)-CAR质粒与mPEG-PCL-PEI(PPP)阳离子长聚合物链共聚物通过静电相互作用络合形成纳米复合物,接着将T细胞靶向抗CD3ε F(ab’)2片段偶联到纳米复合物表面,最后利用α-CD与PPP之间的主客体相互作用,自组装形成超分子水凝胶。该超分子水凝胶在实体瘤瘤旁注射后,可通过持续释放携带pCAR的纳米复合物,实现CAR-T细胞的原位编辑和有效积累,激活T细胞。更为重要的是,相比于静脉输送CAR-T细胞在肿瘤部位累积少等难题,超分子水凝胶剂型对于CAR-T细胞在肿瘤部位的原位和持续改造,能够有效地促进肿瘤组织中CD8+和CD4+ T细胞的浸润,并通过增强促炎症因子(如IL-2、IFN-γ和TNF-α)和肿瘤杀伤蛋白颗粒酶B (GzmB)的表达来减弱实体瘤的免疫抑制微环境,增强抗肿瘤效果。该策略不仅为实体瘤的细胞免疫治疗提供了一种新思路,而且其适用性强,可应用于多种免疫细胞的局部基因改造。2023年11月10日,该工作以“Injectable Supramolecular Hydrogels for in situ Programming of CAR-T cells Towards Solid Tumor Immunotherapy”为题发表在《Advanced Materials》上(Adv. Mater., 2023, doi: 10.1002/adma.202310078)。该研究还得到了浙江大学平渊教授、中国人民解放军陆军军医大学徐祥教授、新加坡材料材料研究与工程研究院(IMRE)Loh Xian Jun教授以及Li Zibiao教授的大力支持。
该工作是团队近期关于阳离子聚合物作为聚轮烷超分子结构以及自组装纳米药物载体设计的最新进展之一。近年来,团队在超分子结构用于尺寸、性能可控载体设计的前期基础上(Angew. Chem. Int. Ed. 2009, 48: 3842; Acc. Chem. Res. 2013, 46: 782; Adv. Healthcare Mater. 2013, 2: 297; Nanoscale 2016, 8: 18876),设计多嵌段聚合物及其自组装形成的纳米胶束结构,高效地利用静电和疏水相互作用包裹并稳定治疗基因质粒;在提升基因转染效率的同时诱导靶蛋白的表达,进而显著减弱肿瘤耐药性(Adv. Healthcare Mater. 2018, 7: 1701143; Chem. Eng. J. 2023, 453: 139879)。团队还进一步探索高分子药物递送载体设计及其在剂型改良药物方面的应用(Small Methods 2021, 5: 2100347; Mil. Med. Res. 2023, 10: 37; ACS Nano 2023, 17: 9826),设计合成有良好生物相容性的两亲性聚氨酯自组装纳米胶束、自组装超分子水凝胶、多臂环糊精衍生化单分子胶束,实现难溶药物、活性大分子的稳定包封以及药物生物利用度提升(Adv. Mater. 2022, 34: 2107674; Bioact. Mater. 2022, 9: 77; Chem. Eng. J. 2023, 453: 139879)。
原文链接:https://doi.org/10.1002/adma.202310078
- 华科大罗志强教授团队《Nat. Commun.》:可注射导电水凝胶实现无线、微创深部脑神经调控 2026-02-10
- 陕科大王学川/党旭岗、温州医科大郑漫辉 AFM:可注射自修复生物质基水凝胶生物粘合剂用于伤口愈合和可穿戴生物电子一体化 2026-01-30
- 四川大学王云兵/张婕妤团队 Adv. Mater.:可注射导电水凝胶贴片通过时空调控实现心肌修复 2025-10-27
- 陕科大王学川教授/党旭岗副教授 Small:盲鳗粘液启发的高拉伸自修复超分子水凝胶用于多功能自供电可穿戴设备 2025-01-20
- 中科大李闯教授 Adv. Mater.:基于CB[8]-螺吡喃主客体化学构建光响应超分子水凝胶 2024-08-28
- 林化所刘鹤研究员、武大陈朝吉教授 Nat. Commun.:纳米纤维素介导的多重动态协同作用构建按需粘附-分离型水凝胶电子皮肤 2024-05-10
- 南京林业大学黄超伯/熊燃华课题组 Nat. Protoc.:光热电纺纳米纤维的胞内递送及其在细胞免疫治疗的应用 2025-01-23
