苏州大学陈倩教授和刘庄教授团队利用临床批准的甾体类抗炎药物-倍他米松磷酸钠,简单与钙离子混合后,通过非共价作用自组装,制备出具有可注射性能的纤维状水凝胶。该水凝胶作为新型的功能性抗体递送系统可以通过调控肿瘤慢性的炎症微环境,来提高免疫检查点阻断疗法的客观响应率并降低其副作用。文章以“Injectable Anti-inflammatory Nanofiber Hydrogel to Achieve Systemic Immunotherapy Post Local Administration”为题发表在Nano Letters上。
免疫检查点阻断(ICB)疗法虽然在临床上取得了一定的成效,但是由于肿瘤微环境的复杂性,仅有小部分患者对ICB治疗产生足够强的免疫响应。炎症是肿瘤微环境中的关键要素之一,在肿瘤发展过程中,各种免疫调节因子的表达都与肿瘤微环境中炎症密切相关。近年来,越来越多的证据表明,肿瘤相关炎症能够通过促进血管新生和转移、颠覆抗肿瘤免疫应答及改变肿瘤细胞对化疗药的敏感性等方面促进肿瘤的生长和进展。持续性的非可控的炎性微环境会干扰了免疫细胞在实体瘤内的活性,从而严重降低了肿瘤对免疫治疗的响应性。因此,重塑肿瘤内慢性炎症微环境能够有效增加抗肿瘤效应T细胞的浸润和激活,是一种提高ICB响应率的有效策略。
苏州大学功能纳米与软物质研究院(FUNSOM)陈倩教授和刘庄教授团队报导了一种基于临床批准的抗炎药-倍他米松(BetP)的可注射纳米纤维水凝胶抗体递送系统(图1)。该纳米纤维水凝胶是由非共价作用(包括分子间氢键,疏水作用,磷酸根与钙离子配位作用)形成的(图2)。在注射水过程中,该水凝胶能从凝胶状态转变为溶胶状态,注射完成时,溶胶状态能够立刻恢复为凝胶状态。包载有anti-PDL1的抗体水凝胶注射到肿瘤后会逐渐降解,一方面水凝胶本身释放出的抗炎药物能够调控肿瘤相关的慢性炎症微环境,包括提高T淋巴细胞的浸润和降低免疫抑制细胞的比例;另一方面该水凝胶能够可控释放anti-PDL1抗体,进一步增强T细胞介导的抗肿瘤免疫反应。在小鼠结肠癌模型中,这种抗体递送系统不仅能够有效抑制原发性肿瘤,而且可以激发系统性的抗肿瘤免疫反应来抑制远端肿瘤的生长(图3)。

图1. 基于倍他米松抗炎药物的纳米纤维水凝剂的制备以及重塑肿瘤炎症微环境以增强ICB疗法的机制。
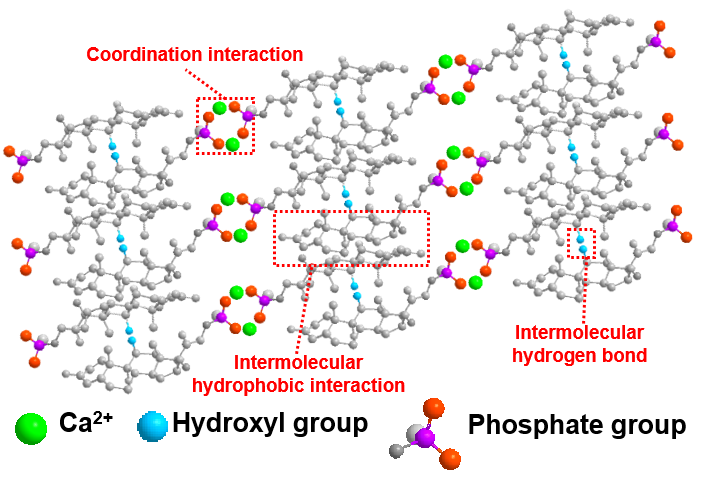
图2. 水凝胶成胶机制示意图

图3. 小鼠结肠癌肿瘤模型治疗。(a)原发性肿瘤局部注射抑制转移性肿瘤示意图;(b)和(c)原发性和转移性肿瘤不同处理组的生长曲线。
论文第一作者为苏州大学FUNSOM研究院硕士研究生陈慕超,通讯作者为FUNSOM陈倩教授和刘庄教授。该研究得到了国家研究项目,国家自然科学基金,江苏省自然科学基金,苏州纳米科技协同创新中心和中国教育部111项目的资助。
论文链接:https://pubs.acs.org/doi/10.1021/acs.nanolett.0c02684
导师介绍:
http://funsom.suda.edu.cn/7c/b0/c2735a294064/page.htm
http://funsom.suda.edu.cn/7f/99/c2735a32665/page.htm
- 华科大罗志强教授团队《Nat. Commun.》:可注射导电水凝胶实现无线、微创深部脑神经调控 2026-02-10
- 陕科大王学川/党旭岗、温州医科大郑漫辉 AFM:可注射自修复生物质基水凝胶生物粘合剂用于伤口愈合和可穿戴生物电子一体化 2026-01-30
- 四川大学王云兵/张婕妤团队 Adv. Mater.:可注射导电水凝胶贴片通过时空调控实现心肌修复 2025-10-27
- 山东大学崔基炜/王连雷教授《ACS Nano》:骨“创可贴”用于骨质疏松性骨折修复 2025-12-07
- 东华大学沈明武研究员/史向阳教授团队:不对称含磷树状大分子递送菠萝蛋白酶用于骨关节炎的抗炎和软骨保护治疗 2025-06-13
- 浙大周民教授团队 Bioact. Mater.:微藻药物递送系统"降尿酸-抗炎-消化系统保护"三位一体协同用于痛风性关节炎的治疗 2025-06-04
- 燕山大学张强团队 AFM:仿生筋膜核壳纳米纤维水凝胶 2026-01-22
